Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%. Xác định khối lượng của vật sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
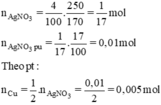
Áp dụng tăng giảm khối lượng

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
Sau phản ứng, lượng AgNO3 giảm đi là khối lượng AgNO3 đã tác dụng \(\Rightarrow n_{AgNO_3}\left(pứ\right)=17\%.\dfrac{1}{17}=0,01\left(mol\right)\) \(Cu\left(0,005\right)+2AgNO_3\left(0,01\right)\rightarrow Cu\left(NO_3\right)_2+2Ag\left(0,01\right)\) Theo PTHH: \(\left\{{}\begin{matrix}n_{Cu\left(tan-ra\right)}=0,005\left(mol\right)\\n_{Ag\left(tao-thanh\right)}=0,01\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{Cu\left(tan-ra\right)}=0,32\left(g\right)\\m_{Ag\left(tao-thanh\right)}=1,08\left(g\right)\end{matrix}\right.\) => Sau phản ứng khối lượng thanh kim loại tăng: \(=1,08-0,32=0,76\left(g\right)\) \(\Rightarrow m_{c.ran-sau-pứ}=20+0,76=10,76\left(g\right)\)PTHH: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
1 2 2
0.005 0.01 0.01(mol)
\(m_{AgNO3}=\frac{250.4}{100}=10\left(g\right)\)
\(\Rightarrow n_{AgNO3\left(pư\right)}=\frac{10.17}{100.170}=0.01\left(mol\right)\)
Khối lượng vật sau phản ứng:
\(10+\left(108.0,01\right)-\left(64.0,005\right)=10,76\left(g\right)\)

a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%

PT: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
a, m AgNO3 (pư) = 250.17%.6% = 2,55 (g)
\(\Rightarrow n_{AgNO_3\left(pư\right)}=\dfrac{2,55}{170}=0,015\left(mol\right)\)
Theo PT: nCu (pư) = 1/2nAgNO3 = 0,0075 (mol)
nAg = nAgNO3 = 0,015 (mol)
⇒ m vật lấy ra = 50 - mCu (pư) - mAg = 51,14 (g)
b, Ta có: m dd sau pư = 0,0075.64 + 250 - 0,015.108 = 248,86 (g)
Theo PT: nCu(NO3)2 = 1/2nAgNO3 = 0,0075 (mol)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{0,0075.188}{248,86}.100\%\approx0,57\%\)
\(C\%_{AgNO_3}=\dfrac{250.6\%-2,55}{248,86}.100\%\approx5\%\)

Cu + 2AgNO3 \(\rightarrow\) Cu(NO3)2 + 2Ag
Ta có : nAgNO3 = 1/17 mol => nAgNO3p.ư = 1/17 . 17/100 = 0,01 mol => m = 10 + 0,01(108 - 64/2) = 10,76 gam
số mol của AdNo3 đem phản ứng= (0,17.250.0,04)/170=0,01 mol
số mol của Cu phản ứng bằng 1/2 số mol của Ag+=0.005mol
=> mCu pứ=0,32gam.
số mol của Ag sinh ra bằng 0,01mol
=> mAg sinh ra là 1,08 gam
mCu ban đầu - mCu pứ + mAg sinh ra đk 10,76 gam

Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g