Cho tam giác ABC vuông tại A có BC = 2 cm và tanB = √3. Tính AB, AC?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a: Xét (O) có
ΔCMD nội tiếp
CD là đường kính
Do đó:ΔCMD vuông tại M
=>DM\(\perp\)CF tại M
b: Xét (O) có AB,CD là các đường kính và AB\(\perp\)CD tại O
nên \(sđ\stackrel\frown{CA}=sđ\stackrel\frown{CB}=sđ\stackrel\frown{AD}=sđ\stackrel\frown{BD}\)
Xét (O) có \(\widehat{MNB}\) là góc có đỉnh ở bên trong đường tròn chắn hai cung MB,AD
=>\(\widehat{MNB}=\dfrac{1}{2}\left(sđ\stackrel\frown{MB}+sđ\stackrel\frown{AD}\right)=\dfrac{1}{2}\left(sđ\stackrel\frown{MB}+sđ\stackrel\frown{BD}\right)=\dfrac{1}{2}\cdot sđ\stackrel\frown{MD}\)
Xét (O) có
\(\widehat{DME}\) là góc tạo bởi tiếp tuyến ME và dây cung MD
=>\(\widehat{DME}=\dfrac{1}{2}\cdot sđ\stackrel\frown{MD}\)
=>\(\widehat{DME}=\widehat{MNB}\)
=>ΔENM cân tại E
Ta có: \(\widehat{EMN}+\widehat{EMF}=\widehat{FMN}=90^0\)
\(\widehat{ENM}+\widehat{EFM}=90^0\)(ΔNMF vuông tại M)
mà \(\widehat{ENM}=\widehat{EMN}\)
nên \(\widehat{EMF}=\widehat{EFM}\)
=>ΔEFM cân tại E


a: Xét ΔBHA vuông tại H và ΔBAC vuông tại A có
\(\widehat{HBA}\) chung
Do đó: ΔBHA~ΔBAC
=>\(\dfrac{BH}{BA}=\dfrac{BA}{BC}\)
=>\(BH\cdot BC=BA^2\)
b: Xét ΔAHB vuông tại H có HD là đường cao
nên \(AD\cdot AB=AH^2\left(1\right)\)
Xét ΔAHC vuông tại H có HE là đường cao
nên \(AE\cdot AC=AH^2\left(2\right)\)
Từ (1),(2) suy ra \(AD\cdot AB=AE\cdot AC\)
=>\(\dfrac{AD}{AC}=\dfrac{AE}{AB}\)
Xét ΔADE vuông tại A và ΔACB vuông tại A có
\(\dfrac{AD}{AC}=\dfrac{AE}{AB}\)
Do đó: ΔADE~ΔACB

Tâm nhĩ co để đẩy máu lên phổi lấy oxi rồi đưa lại về tim, trong khi tâm nhĩ co để đẩy máu giàu oxi đi nuôi khắp cơ thể nên lực co bóp phải mạnh và chậm hơn so với tâm nhĩ co. Như vậy do đường đi của máu từ tâm thất dài hơn đường đi của máu từ tâm nhĩ nên thời gian co bóp lâu hơn, lực mạch hơn.
cho,a≠b≠c (a+b+c)2=a2+b2+c2
c/m \(\dfrac{a^2}{a^2+2bc}+\dfrac{b^2}{b^2+2ac}+\dfrac{c^2}{c^2+2ab}\)=1

từ (a+b+c)^2=a^2+b^2+c^2
suy ra ab+bc+ac=0suy ra ab=-(bc+ac);ac=-(ab+bc);bc=-(ab+ac)
xét a^2+2bc=a^2+bc-ab-ac=(a-c)(a-b)
tương tự dc b^2+2ac=(b-a)(b-c)
c^2+2ab=(a-c)(b-c)
thay vao điều phải c/m dc
a^2/(a-c)(a-b) -b^2/(a-b)(b-c) +c^2(a-c)(b-c)
=a^2b-a^2c-b^2a+b^2c+c^2a-bc^2/(a-b)(a-c)(b-c)
=abc(ac-bc+bc-ab+ab-ac)/(a-b)(a-c)(b-c)=0

Xét tam giác ABC vuông tại A
a, Theo Pytago ta có \(c=\sqrt{a^2-b^2}=3\sqrt{13}\)
sinB = AC/BC = 18/21 = 6/7 => ^B = \(\approx\)590
Do ^B ; ^C phụ nhau => ^C \(\approx\)310
b, Do ^B ; ^C phụ nhau => ^B = 600
tanC = AB/AC = c/b => c = b.tanC = \(\dfrac{10\sqrt{3}}{3}\)
cosC = AC/BC = b/a => a = b/cosC = \(\dfrac{20\sqrt{3}}{3}\)
c, Theo Pytago \(a=\sqrt{b^2+c^2}=\sqrt{34}\)
tanB = AC/AB => ^B \(\approx\)310
Do ^B ; ^C phụ nhau ^C \(\approx\)590

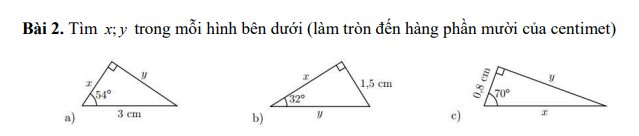
a) Ta có:
\(sin54^o=\dfrac{y}{3}=>y=3\cdot sin54^o\approx2,4\left(cm\right)\\ =>x=\sqrt{3^2-y^2}=\sqrt{9-2,4^2}\approx1,8\left(cm\right)\)
b) Ta có:
\(sin32^o=\dfrac{1,5}{y}=>y=\dfrac{1,5}{sin32^o}\approx2,8\left(cm\right)\\ =>x=\sqrt{y^2-1,5^2}=\sqrt{2,8^2-1,5^2}\approx2,4\)
c) Ta có:
\(tan70^o=\dfrac{y}{0,8}=>y=0,8\cdot tan70^o\approx2,2\left(cm\right)\\ =>x=\sqrt{y^2+0,8^2}=\sqrt{2,2^2+0,8^2}\approx2,3\left(cm\right)\)
Cho tam giác ABC vuông tại A, ^B là góc biết số đo
a, sinB = y/3 => y \(\approx\)2,42 cm
cosB = x/3 => y \(\approx\)1,76 cm
b, sinB = 1,5/y => y = 1,5/sinB \(\approx\)2,83 cm
tanB = 1,5/x => x = 1,5/tanB => x \(\approx\)2,4 cm
c, tanB = y/0,8 => y = 0,8.tanB => y \(\approx\)2,19 cm
cosB = 0,8/x => x = 0,8/cosB => x \(\approx\)2,34 cm

Xét ΔABC vuông tại A có \(tanB=\dfrac{AC}{AB}\)
=>\(\dfrac{AC}{AB}=\sqrt{3}\)
=>\(\dfrac{AC^2}{AB^2}=3\)
=>\(AC^3=3AB^2\)
ΔABC vuông tại A
=>\(AB^2+AC^2=BC^2\)
=>\(4\cdot AB^2=2^2=4\)
=>\(AB^2=1\)
=>AB=1(cm)
=>\(AC=1\cdot\sqrt{3}=\sqrt{3}\left(cm\right)\)