Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`1>{1,2}/3->H` tính theo `H_2.`
Tại TTCB: `[H_2]=3/{2}[NH_3]=0,3M`
`->C_{H_2\ pu}=1,2-0,3=0,9M`
`->H={0,9}/{1,2}.100\%=75\%`
Không có đáp án đúng.

`N_2(g)+3H_2` $\leftrightharpoons$ `2NH_3(g)`
`K_C={[NH_3]^2}/{[N_2].[H_2]^3}={0,3^2}/{0,5.0,1^3}=180`
Không đáp án đúng.

Chọn B
Theo giả thiết ta thấy ban đầu H 2 = N 2 = 1 M .
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng NH 3 = 0 , 4 M
Phương trình phản ứng hoá học :

Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
K C = NH 3 2 N 2 H 2 3 = ( 0 , 4 ) 2 0 , 8. ( 0 , 4 ) 3 = 3 , 125

a, \(N_2+3H_2⇌2NH_3\)
b, Ta có: \(K_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,62^2}{0,45.0,14^3}\approx311,31\)
c, - Tăng nhiệt độ → giảm hiệu suất.
- Tăng áp suất → tăng hiệu suất.
- Thêm bột sắt (xúc tác) → không làm thay đổi hiệu suất.

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì  nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
N2+ 3H2 ⇌ 2NH3
Ban đầu 0,5 0,5 mol
Phản ứng x/3 x 2x/3 mol
Sau pứ 0,2 mol
Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành nên 2x/3= 0,2
→x=0,3


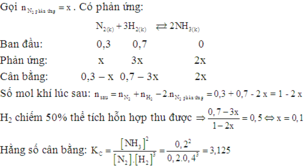

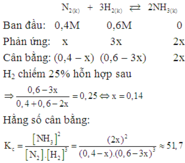


\(N_2+3H_2\underrightarrow{t^o}2NH_3\)
Ta có: \(K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,6^2}{0,02.2^3}=2,25\)
Theo PT: \(\left[N_2\right]_{\left(pư\right)}=\dfrac{1}{2}\left[NH_3\right]=0,3\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,3}{0,3+0,02}.100\%=93,75\%\)