Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TK
2Al+Fe2O3to→Al2O3+2Fe2Al+Fe2O3→toAl2O3+2Fe
Hỗn hợp sau phản ứng gồm A12O3, Fe, Al và Fe2O3.
Khi cho hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 tan, chất rắn còn lại gồm Fe và Fe2O3

$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
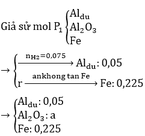
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4




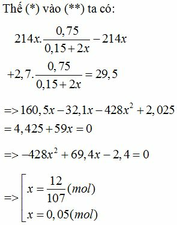
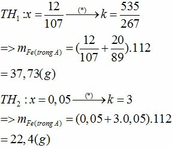

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.