Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
Tính chất của các chất phụ thuộc vào thành phần phân tử (loại nguyên tố, số lượng nguyên tử) và cấu tạo hoá học (trật tự liên kết của các nguyên tử với nhau). Do đó dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate do cấu tạo hoá học khác nhau.

Tính chất của các chất phụ thuộc vào thành phần phân tử (loại nguyên tố, số lượng nguyên tử) và cấu tạo hoá học (trật tự liên kết của các nguyên tử với nhau). Cụ thể ở đây :
- Acetic acid (CH3COOH): có 2 nguyên tử C liên kết với nhau (C - C).
- Methyl fomate (HCOOCH3): có 2 nguyên tử C liên kết với nguyên tử O (C - O - C)
Vì thế nên mặc dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate.

\({\rm{C}}{{\rm{H}}_{\rm{3}}}\mathop {\rm{C}}\limits^{ + 1} {\rm{H = O + }}{\mathop {{\rm{Br}}}\limits^0 _{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}\mathop {\rm{C}}\limits^{ + 3} {\rm{OOH + 2H}}\mathop {{\rm{Br}}}\limits^{ - 1} \)
Trong phản ứng trên, số oxi hoá của C (trong nhóm chức –CHO) tăng từ +1 lên +3, CH3CHO là chất oxi hóa. Số oxi hóa của Br giảm từ 0 xuống -1 , Br2 là chất oxi hóa.

a) 2CH3COOH + Ca → (CH3COO)2Ca + H2 ↑
b) CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
c) 2CH3COOH + CaO → (CH3COO)2Ca + H2O
d) 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O

Tham khảo:
1. Quỳ tím chuyển sang màu đỏ vì acetic acid có tính acid.
2. Kim loại tan dần tạo thành dung dịch màu không màu và có khí không màu thoát ra.
- Mg + 2CH3COOH → (CH3COO)2Mg + H2
3. Tạo dung dịch không màu và có khí thoát ra.
- 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O

Tham khảo:
- Trích mẫu thử.
Cho lần lượt vào mỗi mẫu thử một mẩu giấy quỳ tím.
+ Giấy quỳ tím chuyển sang màu đỏ → mẫu thử là acetic acid và acrylic acid (nhóm I);
+ Giấy quỳ tím không đổi màu → mẫu thử là ethanol và acetaldehyde (nhóm II). Phân biệt nhóm I: Dùng dung dịch bromine
+ Dung dịch bromine nhạt dần đến mất màu → mẫu thử là acrylic acid.
CH2 = CH – COOH + Br2 → CH2Br – CHBr – COOH.
+ Dung dịch bromine không bị mất màu → mẫu thử là acetic acid.
Phân biệt nhóm II: Dùng dung dịch bromine
+ Dung dịch bromine nhạt dần đến mất màu → mẫu thử là acetaldehyde CH3CHO + Br2 + H2O → CH3COOH + 2HBr.
+ Dung dịch bromine không bị mất màu → mẫu thử là ethanol.

\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{\rm{6}}}{{{\rm{60}}}}{\rm{ = 0,1 (mol); }}{{\rm{n}}_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}{\rm{ = }}\frac{{{\rm{5,2}}}}{{46}}{\rm{ }} \approx {\rm{ 0,113 (mol)}}\)
Phương trình hóa học:
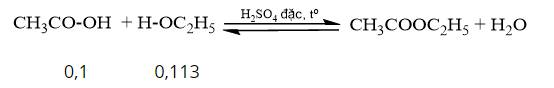
Ta có: \(\frac{{0,1}}{1} < \frac{{0,113}}{1}\) => acetic acid hết, ester tính theo acetic acid.
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = 0,1 (mol) }}\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}} = {\rm{0,1}} \times {\rm{88 = 8,8 (g)}}\\ \Rightarrow {\rm{H = }}\frac{{5,28}}{{8,8}} \times 100\% = 60\% \end{array}\)

Tham khảo
- Đánh số thứ tự cho từng dung dịch. Trích dung dịch làm mẫu thử đánh số thứ tự tương ứng.
- Nhúng mẩu quỳ tím vào các mẫu thử:
+ Mẫu thử chứa acetic acid làm quỳ tím hóa đỏ.
+ Ba mẫu thử chứa ethanol, glycerol, acetaldehyde không làm quỳ tím đổi màu.
- Tiếp tục trích mẫu thử của ba dung dịch không làm quỳ tím đổi màu.
- Cho vào mỗi mẫu thử vài giọt dung dịch copper(II) sulfate và 1 mL dung dịch sodium hydroxide, tạo kết tủa xanh lam Cu(OH)2.
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
- Lắc nhẹ các mẫu thử:
+ Mẫu thử chứa glycerol làm tan kết tủa xanh lam thành dung dịch màu xanh lam.
+ Hai mẫu thử chứa ethanol và acetaldehyde không làm tan kết tủa.
- Tiếp tục đun nóng nhẹ hai mẫu thử chứa ethanol và acetaldehyde và Cu(OH)2:
+ Mẫu thử chứa acetaldehyde xuất hiện kết tủa đỏ gạch Cu2O.
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O + 3H2O
+ Mẫu thử không có hiện tượng là ethanol.

\(n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{12}{46}=\dfrac{6}{23}\left(mol\right)\\ PTHH:CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ Vì:0,2:1< \dfrac{6}{23}:1\Rightarrow Ethanol.dư\\ n_{este\left(LT\right)}=n_{acid}=0,2\left(mol\right)\\ n_{este\left(TT\right)}=\dfrac{8}{88}=\dfrac{1}{11}\left(mol\right)\\ \Rightarrow H=\dfrac{\dfrac{1}{11}}{0,2}.100\%\approx45,455\%\)
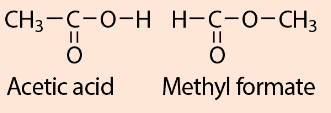
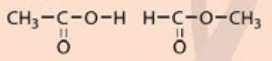

CTCT của acetic acid: \(CH_3-COOH\)
Một số tính chất hóa học:
- Hợp chất hữu cơ có tính axit mạnh, làm quỳ chuyển sang màu đỏ.
- Tác dụng được với kim loại trước H, oxit bazo, bazo, muối trung hòa, muối axit, rượu.
Ứng dụng của acetic acid:
- dung môi hòa tan các chất hóa học, sản xuất thuốc nhuộm, bảo quản thực phẩm...