Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: H2 + Cl2 --as--> 2HCl
Xét tỉ lệ: \(\dfrac{\dfrac{5}{112}}{1}>\dfrac{0,03}{1}\) => Hiệu suất tính theo Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
Bảo toàn Cl: \(n_{Cl_2\left(pư\right)}=0,025\left(mol\right)\)
\(H\%=\dfrac{0,025}{0,03}.100\%=83,33\%\)

\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)

\(H_2 + Cl_2 \xrightarrow{ánh\ sáng} 2HCl\\ n_{H_2} < n_{Cl_2} \Rightarrow \text{Hiệu suất tính theo số mol }\ H_2\\ n_{H_2\ pư} = 0,3.80\% = 0,24(mol)\\ HCl + NaOH \to NaCl + H_2O\\ n_{NaOH} = n_{HCl} = 2n_{H_2\ pư} = 0,48(mol)\\ V_{dd\ NaOH} = \dfrac{0,48}{1} = 0,48(lít) = 480(ml) \)




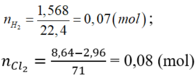
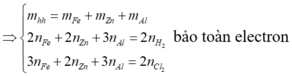
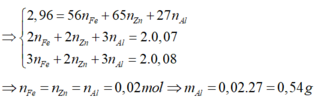
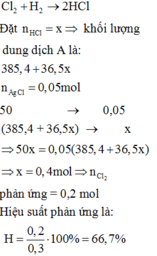
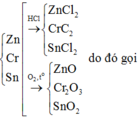
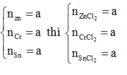


\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
________0,4____________0,2 (mol)
\(Cl_2+H_2\underrightarrow{t^o}2HCl\)
0,2__________0,4 (mol)
\(\Rightarrow H=\dfrac{0,2}{0,3}.100\%\approx66,67\%\)