Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 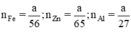
Theo pt nH2 (1) = nZn = 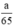 mol
mol
nH2 (2) = nFe = 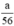 mol
mol
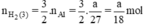
Như vậy ta nhận thấy 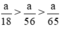 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.

a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)

a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.


Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.

Tỉ lệ trong ptpư của hai kim loại so với H2 như nhau nên KL nào có số mol nhiều hơn sẽ sản ra nhiều H2 hơn.
m bằng nhau mà MMg <MFe nên nMg>nFe do đó Mg sản ra nhiều H2 hơn
ta co :
pthh Mg + H2SO4 ---> MgSO4 + H2
Fe + H2SO4 ----> FeSO4 + H2
=> H2 = nhau

- pt: Zn + 2HCl -> ZnCl2 +H2
- nHCl = ( 3,25 : 65 ) x 2 = 0,1 (mol)
V = 0,1 : 0,5 = 0,2 (l)
- gọi a là số mol cần tìm
- pt: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
a -> 3/2a
Fe + H2SO4 -> FeSO4 + H2
a -> a
- ta có : a + 3/2a = 0,05 => a = 0,02 (mol)
- C%Fe = ( 0,02 x 56)x100 / (0,02x56 + 0,02x 27) = 67,47%
- C% Al = 100 -67,47= 32,53%

Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
a) Đặt khối lượng của ba kim loại là 1 gam
→ nFe = 1/56 mol, nZn = 1/65 mol, nAl = 1/27 mol
→ Số mol H2 do sắt tạo thành: nH2 (1) = 1/56 mol
Số mol H2 do kẽm tạo thành: nH2 (2) = 1/65 mol
Số mol H2 do nhôm tạo thành: nH2 (3) = 1/18 mol
→ Số mol H2 (2) < (1) < (3)
→ Nếu lấy cùng khối lượng mỗi kim loại trên thì nhôm có thể tạo ra nhiều khí nhất.
b) Đặt số mol khí H2 tạo thành là 1 mol
→ nFe = 1 mol → m Fe = 56 gam
nZn = 1 mol → mZn = 65 gam
nAl = 2/3 mol → mAl = 18 gam
→ Để tạo thành được 1 mol khí H2 thì dùng Al sẽ tốn ít kim loại nhất

Câu 2 :
Số mol của magie
nMg = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
a) Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
0,2 0,2 0,2
b) Số mol của magie clorua
nMgCl2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của magie clorua
mMgCl2 = nMgCl2 . MMgCl2
= 0,2 . 95
= 19 (g)
c) Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
Chúc bạn học tốt



