Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
- Gọi x, y lần lượt là số mol của \(CuO,ZnO\)
PTHH.
\(CuO+2HCl\rightarrow CuCl_2+H_2O\left(1\right)\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\left(2\right)\)
- Ta có hệ phương trình sau:
\(80x+81y=24,2\)
\(2x+2y=0,6\)
Giải hệ pt ta được: \(x=0,1\left(mol\right);y=0,2\left(mol\right)\)
\(\%m_{CuO}=\left(80.0,1:24,2\right).100\%=33,05\%\)
\(\%m_{ZnO}=100\%-33,05\%=66,95\%\)
200 ml =0,2 l
\(n_{HCl}=0,2.3=0,6\left(mol\right)\)
\(CuO+2HCl->CuCl_2+H_2O\left(1\right)\)
a 2a (mol)
\(ZnO+2HCl->ZnCl_2+H_2O\left(2\right)\)
b 2b (mol)
ta có
\(\begin{cases}80a+81b=24,2\\2a+2b=0,6\end{cases}\)
giả ra ta được a =0,1 (mol)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
thành phần % theo khối lượng mỗi oxit trong hỗn hợp ban đầu là
%CuO = \(\frac{8}{24,2}.100\%=33,06\%\)
%ZnO= 100% - 33,06% = 66,94%

Pt : \(CuO+2HCl\rightarrow CuCl_2+H_2O|\)
1 2 1 1
a 2a
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O|\)
1 2 1 1
b 2b
a) Gọi a là số mol của CuO
b là số mol của ZnO
\(m_{CuO}+m_{ZnO}=11,2\left(g\right)\)
⇒ \(n_{CuO}.M_{CuO}+n_{ZnO}.M_{ZnO}=12,1g\)
⇒ 80a + 81b = 12,1g (1)
150ml = 0,15l
\(n_{HCl}=2.0,15=0,3\left(mol\right)\)
⇒ 2a +2b = 0,3(2)
Từ (1),(2) , ta có hệ phương trình :
80a + 81b = 12,1
2a + 2b = 0,3
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(m_{CuO}=0,05.80=4\left(g\right)\)
\(m_{ZnO}=0,1.81=8,1\left(g\right)\)
0/0CuO = \(\dfrac{4.100}{12,1}=33,06\)0/0
0/0ZnO = \(\dfrac{6,5.100}{12,1}=53,71\)0/0
b) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,05 0,05
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O|\)
1 1 1 1
0,2 0,2
\(n_{H2SO4\left(tổng\right)}=0,05+0,2=0,25\left(mol\right)\)
⇒ \(m_{H2SO4}=0,25.98=24,5\left(g\right)\)
\(m_{dd}=\dfrac{24,5.100}{20}=122,5\left(g\right)\)
Chúc bạn học tốt

Đổi 300ml = 0,3 lít
Ta có: \(n_{HCl}=2.0,3=0,6\left(mol\right)\)
a. PTHH:
CuO + 2HCl ---> CuCl2 + H2O (1)
ZnO + 2HCl ---> ZnCl2 + H2O (2)
b. Gọi x, y lần lượt là số mol của CuO và ZnO
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{ZnO}=2y\left(mol\right)\)
=> 2x + 2y = 0,6 (*)
Theo đề, ta có: 80x + 81y = 24,2 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+2y=0,6\\80x+81y=24,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
=> \(\%_{m_{CuO}}=\dfrac{8}{24,2}.100\%=33,06\%\)
\(\%_{m_{Zn}}=100\%-33,06\%=66,94\%\)
c. PTHH:
CuO + H2SO4 ---> CuSO4 + H2O (3)
ZnO + H2SO4 ---> ZnSO4 + H2O (4)
Theo PT(3): \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
Theo PT(4): \(n_{H_2SO_4}=n_{ZnO}=0,2\left(mol\right)\)
=> \(n_{H_2SO_4}=0,1+0,2=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

a. PTHH:
\(Cu+H_2SO_4--\times-->\)
\(CuO+H_2SO_4--->CuSO_4+H_2O\left(1\right)\)
\(Cu+2H_2SO_{4_{đặc}}\overset{t^o}{--->}CuSO_4+SO_2+2H_2O\left(2\right)\)
Ta có: \(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Cu}=n_{SO_2}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,05.64=3,2\left(g\right)\)
\(\Rightarrow\%_{m_{Cu}}=\dfrac{3,2}{10}.100\%=32\%\)
\(\%_{m_{CuO}}=100\%-32\%=68\%\)

CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g

C32:
a, \(n_C=\dfrac{2,4}{12}=0,2\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_{CO_2}=n_C=0,2\left(mol\right)\Rightarrow V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{NaOH}=0,3.1=0,3\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=1,5\) → Pư tạo NaHCO3 và Na2CO3
PT: \(CO_2+NaOH\rightarrow NaHCO_3\)
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{NaHCO_3}+n_{Na_2CO_3}=0,2\\n_{NaOH}=n_{NaHCO_3}+2n_{Na_2CO_3}=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHCO_3}=0,1\left(mol\right)\\n_{Na_2CO_3}=0,1\left(mol\right)\end{matrix}\right.\)
⇒ mNaHCO3 = 0,1.84 = 8,4 (g)
mNa2CO3 = 0,1.106 = 10,6 (g)
c, \(C_{M_{NaHCO_3}}=C_{M_{Na_2CO_3}}=\dfrac{0,1}{0,3}=\dfrac{1}{3}\left(M\right)\)
Lần sau bạn đăng tách câu hỏi ra nhé.
C31:
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{14,6}.100\%\approx44,52\%\\\%m_{ZnO}\approx55,48\%\end{matrix}\right.\)
c, \(n_{ZnO}=\dfrac{14,6-0,1.65}{81}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}+2n_{ZnO}=0,4\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,4.36,5}{10\%}=146\left(g\right)\)
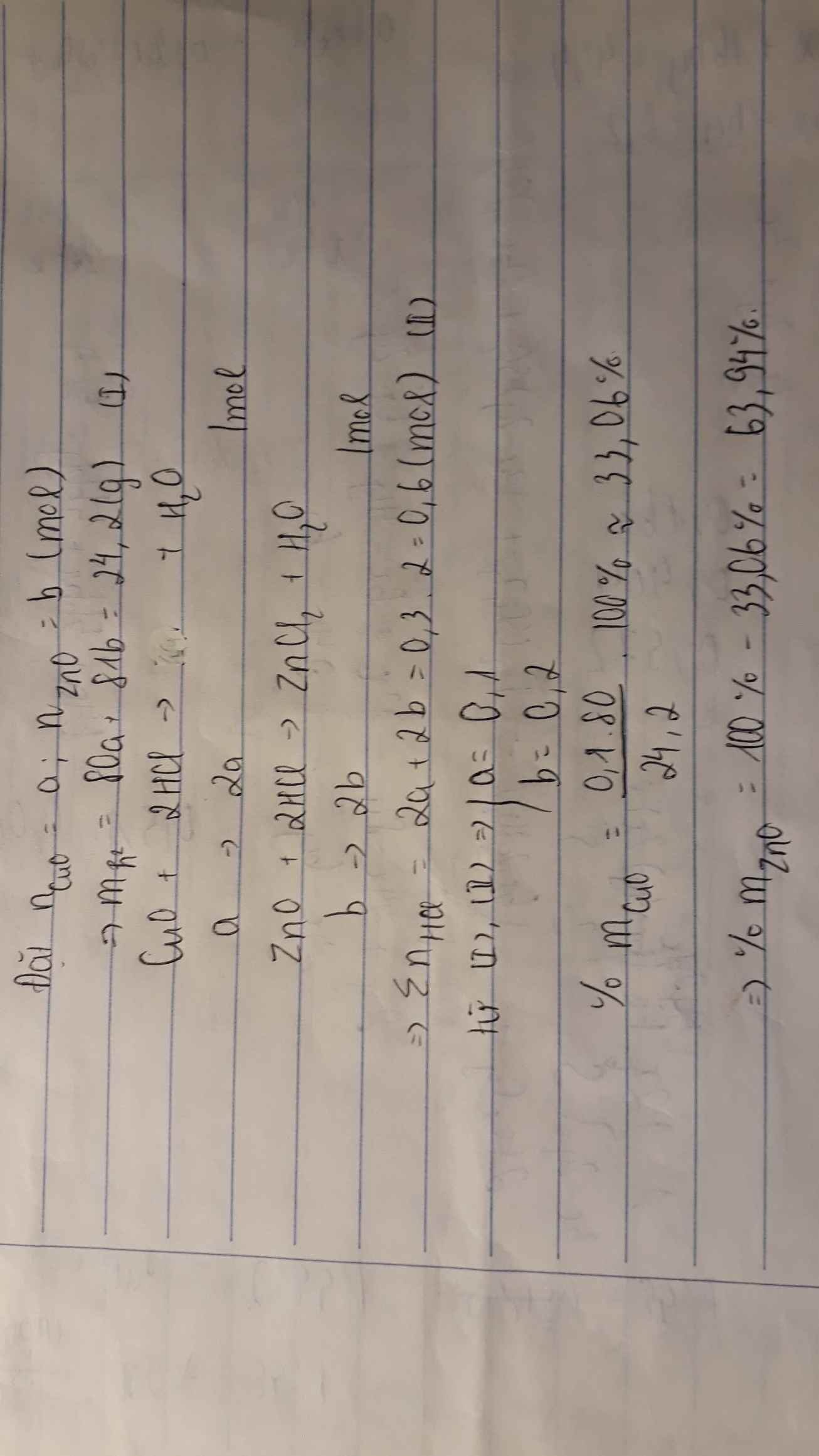
các câu hỏi tương tự có đấy
Câu 1:a) nH2= 4,48/22,4=0,2(mol)
PTHH: Zn + 2 HCl -> ZnCl2 + H2
0,2_________0,4______0,2______0,2(mol)
nZn= nH2= 0,2(mol) => mZn= 0,2.65=13(g)
\(\%mZn=\frac{13}{21,1}.100\approx61,611\%\\ \Rightarrow\%mZnO\approx100\%-61,611\%\approx38,389\%\)
b) => mZnO= mhhA- mZn= 21,1-13=8,1(g)
=> nZnO= 8,1/81= 0,1(mol)
PTHH: ZnO + 2 HCl -> ZnCl2 + H2O
0,1_________0,2_____0,1(mol)
mZnCl2= 0,2.136+0,1.136=40,8(g)
mddsau= mhhA++mddHCl-mH2= 21,1+200 - 0,2.2= 220,7(g)
=> C%ddZnCl2= (40,8/220,7).100\(\approx18,487\%\)