Bài 1: Cho 16g Copper (II) sulfate CuSO4 tác dụng vừa đủ với 200ml dung dịch Sodium hydroxide NaOH. Sau phản ứng thu được kết tủa, lọc kết tủa đem nung đến khối lượng không đổi được rắn A.
a) Viết PTHH của phản ứng
b) Tính khối lượng chất rắn thu được.
c) Tính nồng độ mol dung dịch NaOH đã dùng.
Bài 2: Cho 4,8 gam Copper (II) oxide CuO tác dụng hết với dung dịch Hydrochloric acid HCl 8%, được dung dịch X.
a) Viết phương trình hóa học xảy ra và nêu hiện tượng quan sát được.
b) Tính khối lượng dung dịch HCl cần dùng.
c) Tính nồng độ phần trăm của dung dịch X.
Bài 3: Cho 41,6 gam Barium chloride BaCl2 tác dụng vừa đủ với dung dịch Sulfuric acid H2SO4 24,5%. Hãy tính
a) Khối lượng kết tủa trắng thu được.
b) Khối lượng dung dịch H2SO4 24,5% cần dùng
Bài 4: Hòa tan hoàn toàn 22,4 gam bột Iron Fe trong 200 gam dung dịch Hydrochloric acid HCl. Sau phản ứng thu được dung dịch muối Iron (II) chloride FeCl2 và chất khí A ở điều kiện tiêu chuẩn (đktc).
a) Tính thể tích khí A ở (đktc) và khối lượng muối thu được sau phản ứng.
b) Tính nồng độ phần trăm dung dịch Hydrochloric acid HCl tham gia phản ứng.
Bài 5:
a) Viết các PTHH của quá trình sản xuất Sulfuric acid H2SO4 tử Sulfur S
b) Nêu cách pha loãng Sulfuric acid từ Sulfuric acid đậm đặc.
c) Cho kim loại Zinc Zn vào dung dịch Sulfuric acid H2SO4 0,5M. Sau khi phản ứng kết thúc thu được 1,2395 lít khí (ở điều kiện tiêu chuẩn).
- Viết phương trình hóa học của phản ứng trên.
- Tính khối lượng của Zinc Zn tham gia phản ứng
- Tính thể tích của dung dịch Sulfuric acid H2SO4 0,5M cần dùng để hòa tan hoàn toàn lượng kim loại Zinc Zn trên.


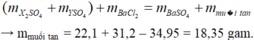

\(n_{CuSO_4}=\dfrac{48}{160}=0,3mol\)
\(n_{BaCl_2}=\dfrac{82,2}{208}=0,39mol\)
\(CuSO_4+BaCl_2\rightarrow BaSO_4+CuCl_2\)
0,3 < 0,39 ( mol )
0,3 0,3 0,3 0,3 ( mol )
\(m_{BaCl_2\left(dư\right)}=\left(0,39-0,3\right).208=18,72g\)
\(m_{BaSO_4}=0,3.233=69,9g\)
Cách 1. \(m_{CuCl_2}=0,3.135=40,5g\)
Cách 2. \(m_{BaCl_2\left(pứ\right)}=0,3.208=62,4g\)
Áp dụng ĐL BTKL, ta có:
\(m_{CuSO_4}+m_{BaCl_2}=m_{BaSO_4}+m_{CuCl_2}\)
\(\rightarrow m_{CuCl_2}=48+62,4-69,9=40,5g\)