Đun nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí, thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y cñ tỉ khối so với H2 là 13. Lấy 2,24 lít (đo ở điều kiện tiêu chuẩn) khí Y đem đốt cháy rồi cho toàn bộ sản phẩm cháy đñ đi qua 100 ml dung dịch H2O2 5,1% (có khối lượng riêng bằng 1g/ml), sau phản ứng thu được dung dịch B. Các phản...
Đọc tiếp
Đun nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí, thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y cñ tỉ khối so với H2 là 13. Lấy 2,24 lít (đo ở điều kiện tiêu chuẩn) khí Y đem đốt cháy rồi cho toàn bộ sản phẩm cháy đñ đi qua 100 ml dung dịch H2O2 5,1% (có khối lượng riêng bằng 1g/ml), sau phản ứng thu được dung dịch B. Các phản ứng xảy ra hoàn toàn.
a. Tính thành phần % khối lượng các chất trong hỗn hợp X. (%Fe = 70%; %S = 30%)
b. Xác định nồng độ % các chất trong dung dịch B. (C%H2SO4 = 6,695%; C%H2O2 = 2,392%)Đun nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí, thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y cñ tỉ khối so với H2 là 13. Lấy 2,24 lít (đo ở điều kiện tiêu chuẩn) khí Y đem đốt cháy rồi cho toàn bộ sản phẩm cháy đñ đi qua 100 ml dung dịch H2O2 5,1% (có khối lượng riêng bằng 1g/ml), sau phản ứng thu được dung dịch B. Các phản ứng xảy ra hoàn toàn.
a. Tính thành phần % khối lượng các chất trong hỗn hợp X. (%Fe = 70%; %S = 30%)
b. Xác định nồng độ % các chất trong dung dịch B. (C%H2SO4 = 6,695%; C%H2O2 = 2,392%)


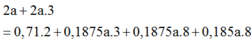

\(n_{khí}=n_{SO_2}=0,2\left(mol\right)\\ n_{hhkhí}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH:
2H2S + 3O2 --to--> 2H2O + 2SO2
0,2 <-------------------------------- 0,2
\(\rightarrow n_{H_2}=0,4-0,2=0,2\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2 <------------------------ 0,2
FeS + 2HCl ---> FeCl2 + H2S
0,2 <-------------------------- 0,2
Fe + S --to--> FeS
0,2 <- 0,2 <---- 0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=\left(0,2+0,2\right).56=22,4\left(g\right)\\m_S=0,2.32=6,4\left(g\right)\end{matrix}\right.\)
PTHH: SO2 + 2H2O + Br2 ---> H2SO4 + 2HBr
0,2 --------------> 0,2
\(\rightarrow m_{Br_2}=0,2.160=32\left(g\right)\)