Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tính chất vật lý chung của phi kim:
- Tồn tại ở 3 thể:
+ thể rắn: C, S, P
+ thể khí: \(H_2,N_2,Cl_2\)
+ thể lỏng: \(Br_2,I_2\)
- Phi kim dẫn điện, dẫn nhiệt kém và không có ánh kim.
Tính chất hóa học chung của phi kim:
- Tác dụng với kim loại:
Vd: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
- Tác dụng với hidro:
+ oxi tác dụng với hidro tạo \(H_2O\)
+ hidro tác dụng với \(Cl_2\) được khí HCl
- Tác dụng với oxi:
Vd: \(2P+\dfrac{5}{2}O_2\underrightarrow{t^o}P_2O_5\)

Clo là một phi kim hoạt động hoá học...(1)mạnh...Clo có những tính chất hoá học của...(2)phi kim...như:tác dụng với hầu hết kim loại tạo thành muối clorua,tác dụng với...(3)hidro...tạo thành khí hidro clorua

Tham khảo:
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối:
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro
+ Khí oxi tác dụng với hiđro tạo thành hơi nước:
- Clo tác dụng với hiđro
+ Hiđro cháy trong khí clo tạo thành khí không màu. Màu vàng lục của khí clo biến mất. Giấy quỳ tím hóa đỏ.
+ Khí clo đã phản ứng mạnh với hiđro tạo thành khí hiđro clorua không màu. Khí này tan trong nước tạo thành dung dịch axit clohiđric và làm quỳ tím hóa đỏ.
- Ngoài ra, nhiều phi kim khác như C, S, Br2,... tác dụng với hiđro cũng tạo thành hợp chất khí.
=>Phi kim phản ứng với hiđro tạo thành hợp chất khí.
3. Tác dụng với oxi
=>Nhiều phi kim tác dụng với oxi tạo thành oxit axit.
4. Mức độ hóa học của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro. Flo, oxi, clo là những phi kim hoạt động mạnh, flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.

(1) \(S+H_2\underrightarrow{t^o}H_2S\)
(2) \(Cu+S\underrightarrow{t^o}CuS\)
(3) \(S+O_2\underrightarrow{t^o}SO_2\)

Cl 2 có tính phi kim mạnh hơn S nên phản ứng dễ dàng với Fe và oxi hoá Fe lên hoá trị III, còn S tác dụng với Fe khi đốt nóng và oxi hoá Fe đến hoá trị II.
2Fe + 3 Cl 2 → 2Fe Cl 3
Fe + S → FeS
Có thể dự đoán được là Cl 2 có thể đẩy được S ra khỏi H 2 S :
Cl 2 + H 2 S → 2HCl + S

TCHH chung:
- Td với kl.
Vd: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(Fe+S\rightarrow FeS\)
- Td với hidro:
Vd: \(Cl_2+H_2\underrightarrow{as}2HCl\)
\(H_2+S\rightarrow H_2S\)
- Td với oxi:
Vd: \(2P+\dfrac{5}{2}O_2\underrightarrow{t^o}P_2O_5\)
TCHH riêng:
- Clo tác dụng với nước:
Vd:
\(Cl_2+H_2O\rightarrow HCl+HClO\)
\(HClO\rightarrow HCl+O\)
- Clo tác dụng với dd kiềm nguội/ đặc nóng.
Vd:
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
\(3Cl_2+6KOH_{đn}\rightarrow5KCl+KClO_3+3H_2O\)

a: Cấu tạo nguyên tử của A là 11 proton và 11 electron
Cấu hình: \(1s^22s^22p^63s^1\)
Vị trí: Chu kì 3, nhóm IA
b: A là kim loại vì có 1 e lớp ngoài cùng


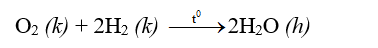
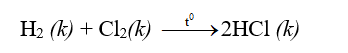
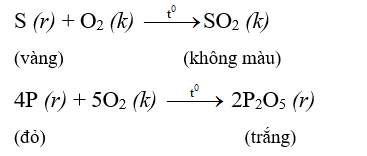
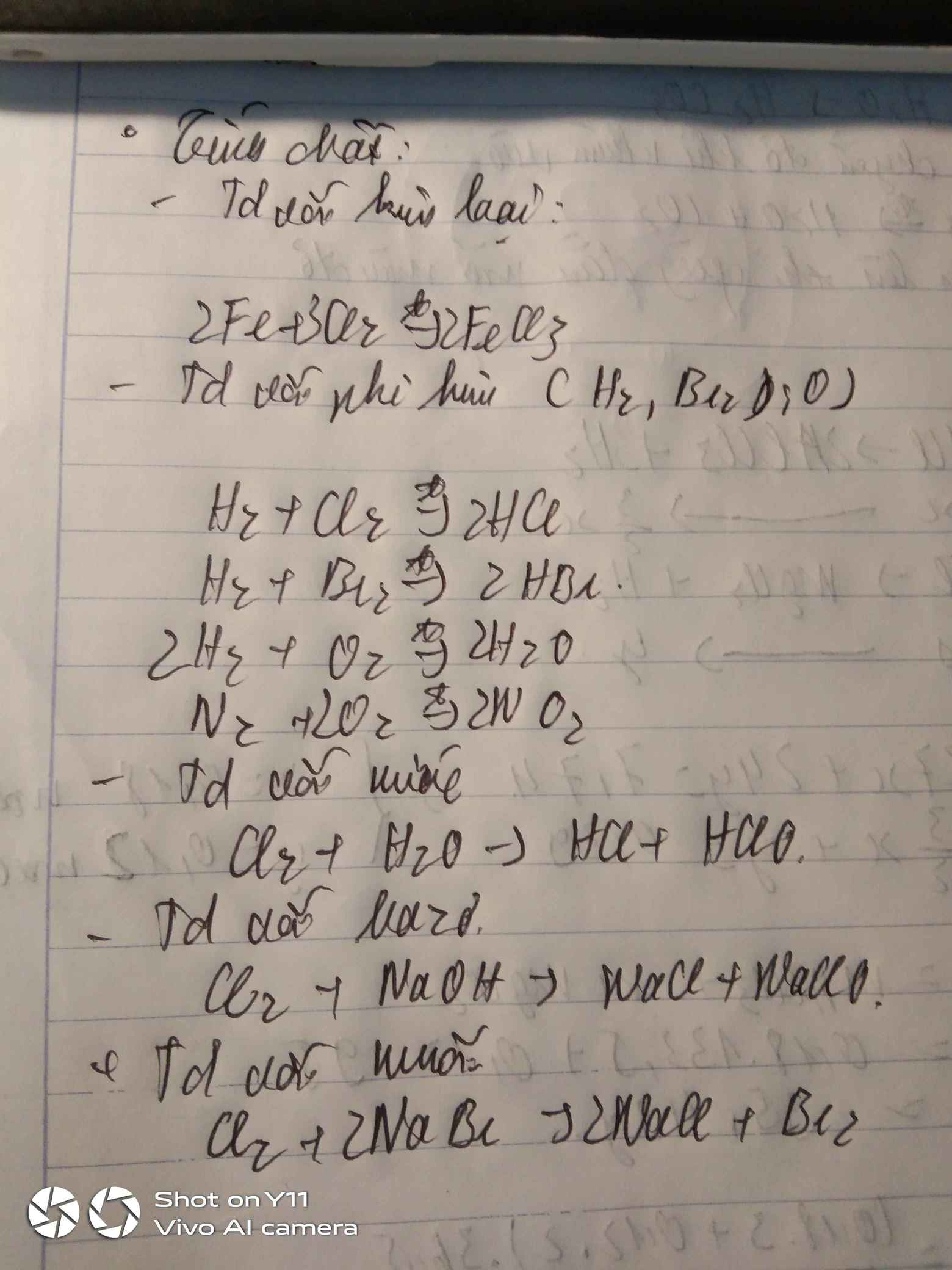
 Sơ đồ 1
Sơ đồ 1

-Tác dụng với hidro :
\(S + H_2 \xrightarrow{t^o} H_2S\)
-Tác dụng với kim loại :
\(Fe + S \xrightarrow{t^o} FeS\\ Zn + S \xrightarrow{t^o} ZnS\)
- Tác dụng với oxi :
\( S+ O_2 \xrightarrow{t^o} SO_2\)
- Tác dụng với chất có tính oxi mạnh :
\(S + 2H_2SO_4 \to 3SO_2 + 2H_2O\)
\(S + 4HNO_3 \to SO_2 + 4NO_2 + 2H_2O\)