Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(V_{CH_4} = 100.96\% = 96(lít)\\ V_{CO_2} = 100.2\% = 2(lít)\\ CH_4 + O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ \)
Ta có :
\(V_{CO_2\ thải\ ra} = V_{CH_4} + V_{CO_2} = 96 + 2 = 98(lít)\)
\(\%V_{CH_4}=96\left(l\right)\)
\(CH_4+O_2\rightarrow CO_2+2H_2O\)
- Thấy cứ 1l CH4 tạo ra 1l CO2
=> 96l CH4 tạo ra x l CO2 .
=> X = 96 ( l )
Vậy cứ đốt 100 lít khí thiên nhiên sẽ thải ra 96l khí CO2

\(CH_4+2O_2\rightarrow CO_2+2H_2O\\ n_{CH_4}=\dfrac{1}{2}n_{O_2}=\dfrac{1}{2}.\dfrac{2,128}{22,4}=0,0475\left(mol\right)\\ \%V_{CH_4}=\dfrac{0,0475.22,4}{1,12}.100=95\%\)

a ,vì n2,co2 không cháy => pt hóa học: CH4 + 2O2 ----> CO2 + 2H2O
toàn bộ sp cháy dẫn qua dd Ca(OH)2 dư tạo ra kết tủa=> pt hóa học: CO2 + Ca(OH)2 dư ----> CaCO3 + H2Ob,gọi số mol hỗn hợp là x=> mol CH4 = 0.96x , mol CO2 trước phản ứng = 0.02xpt hóa học: CH4 + 2O2 ----> CO2 + 2H2Otheo pt 0.96x 0.96x (mol)pt hóa học: CO2 + Ca(OH)2 dư ----> CaCO3 + H2Otheo pt 0.049 0.049 (mol)=> tổng số mol CO2: 0.96x + 0.02x = 0.049 => x = 0.05=> v = 0.05 x 22.4 = 1.12 l
1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
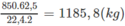
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
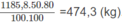
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
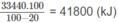

Đáp án: B
Ta có cứ V lít khí thiên nhiên có 0,96V lít khí CH4; 0,02V lít N2 và 0,02V lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O (1)
0,96V → 0,96V lít.
Thể tích CO2 thu được sau khí đốt:
VCO2 = VCO2 ban đầu + VCO2 (1) = 0,02V + 0,96V = 0,98V (lít)
Cho sản phẩm cháy vào nước vôi trong dư, kết tủa là CaCO3
n↓ = 29 , 4 100 = 0 , 294 mol = nCO2
Vậy VCO2 = 0,294.22,4 = 0,98V → V = 6,72 lít.


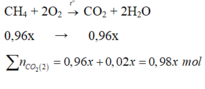
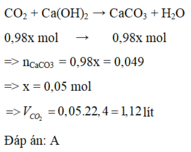


VCH4 = 0.96 (l)
VCO2 = 0.02 (l)
CH4 + 2O2 -to-> CO2 + H2O
VCO2 = 0.96 + 0.02 = 0.98 (l)