Cho 6,5 gam một kim loại Kẽm tác dụng hoàn toàn với axit clohidric ( HCl) thu được 9,5 gam muối kẽm clorua( ZnCl2) và 0,9 gam khí hidro bay ra.a) Viết phương trình chữ là lập pthh của phản ứngb) cho biết tỉ lệ số nguyên tử, phân tử giữa các chất có trong phản ứng trênc) Tính khối lượng của axit clohidric đã tham gia phản ứngP/s: Mọi người giúp mình giải gấp bài này với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

a) Zn + 2HCl --> ZnCl2 + H2
b) Theo ĐLBTKL: mZn + mHCl = mZnCl2 + mH2
=> mH2 = 5,2 + 5,84 - 10,88 = 0,16 (g)
c) \(n_{H_2}=\dfrac{0,16}{2}=0,08\left(mol\right)\)
=> VH2 = 0,08.22,4 = 1,792(l)

Bài 1 :
a.
Kẽm + Axit clohidric => Kẽm clorua + Khí hidro
\(m_{Zn}+m_{HClk}=m_{ZnCl_2}+m_{H_2}\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b.
Áp dụng định luật bảo toàn khối lượng :
\(m_{Zn}+m_{HCl\left(bđ\right)}=m_{ZnCl_2}+m_{H_2}+m_{HCl\left(dư\right)}\)
c.
Ta có :
\(\dfrac{n_{Zn}}{1}=\dfrac{6.5}{65}=0.1< \dfrac{n_{HCl}}{2}=\dfrac{10.95}{2}=0.15\)
\(\Rightarrow\) \(\text{HCl dư }\)
\(n_{ZnCl_2}=n_{Zn}=0.1\left(mol\right)\)
\(m_{ZnCl_2}=0.1\cdot136=13.6\left(g\right)\)
\(d.\)
\(n_{HCl\left(pư\right)}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{HCl\left(pư\right)}=0.2\cdot36.5=7.3\left(g\right)\)

\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,1 0,1 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\)
⇒ Zn dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
\(n_{ZnCl2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,05.136=6,8\left(g\right)\)
Chúc bạn học tốt

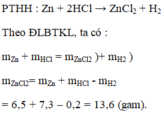

a) Phương trình chữ: Kẽm + Axit Clohidric \(--->\) Kẽm Clorua + Hidro
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Tỉ lệ 1 : 2 : 1 : 1
c) Bảo toàn khối lượng: \(m_{HCl}=m_{ZnCl_2}+m_{H_2}-m_{Zn}=3,9\left(g\right)\)