1/ hãy nêu phương pháp nhận biết các lọ đựng riêng biệt các dung dịch mất nhãn: HCl; H2SO4 ;HNO3 Viết các phương trình hoá học xảy ra.
2/ bằng phương pháp hóa học ,chỉ dùng thêm một kim loại Cu phân biệt các chất sau đây đựng trong các lọ không nhãn : HCl; HNO3;NaOH ; AgNO3;NaNO3; HgCl2.



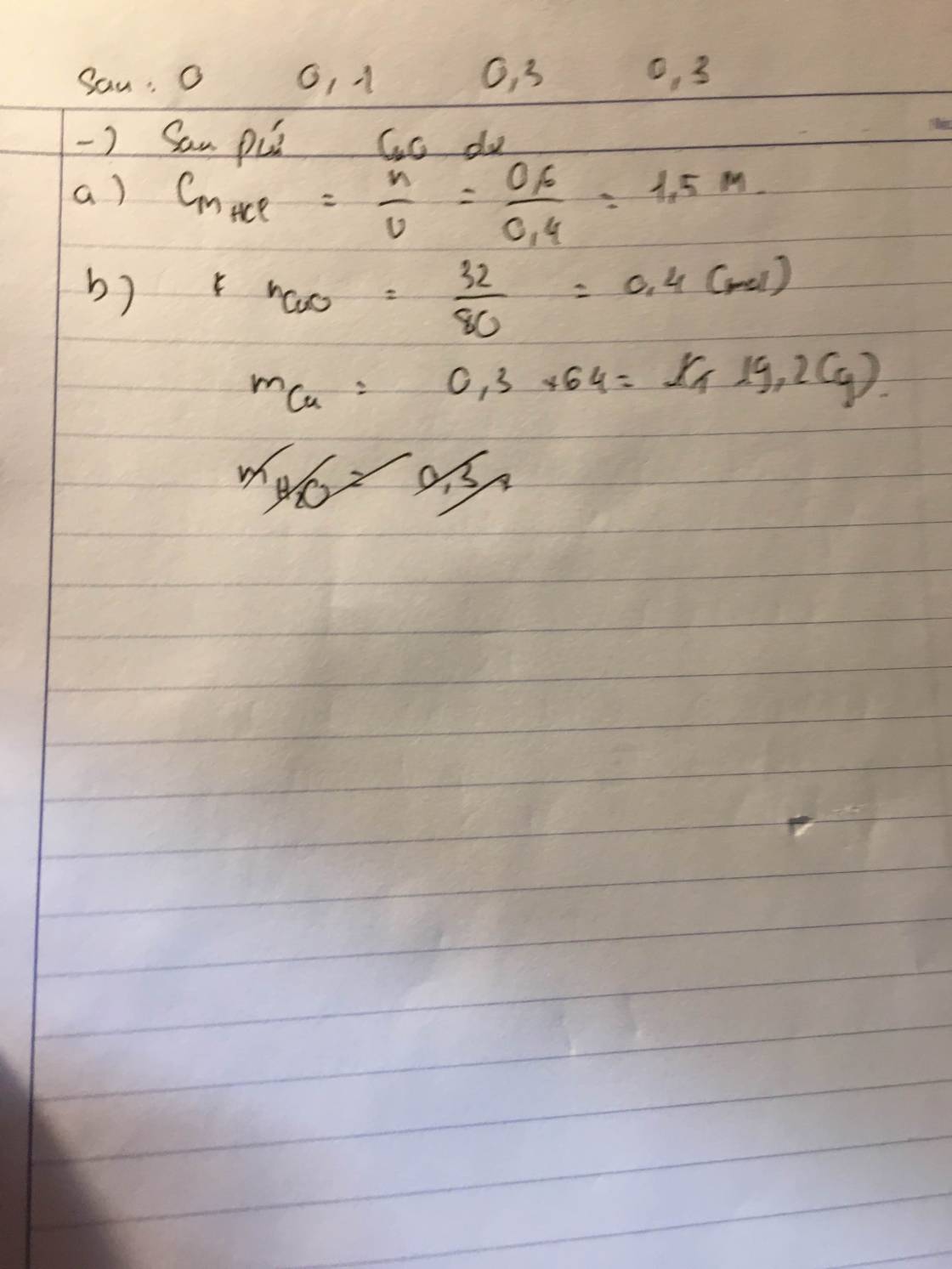

2.-Trích mỗi lọ một ít làm mẫu thử
-cho Cu tác dụng từng chất, nhận ra HNO3 có khí không màu hóa nâu trong không khí(NO).Nhận ra AgNO3 và HgCl2 vì pư tạo dung dịch màu xanh.
-Dùng dung dịch muối Cu tạo ra, nhận ra được NaOH có kết tủa xanh lơ.
Dùng Cu(OH)2 để nhận ra HCl làm tan kết tủa.
-Dùng dd HCl để phân biệt AgNO3 và HgCl2 ( có kết tủa trắng là AgNO3 )
PTHH:3Cu + 8HNO3 -->3Cu(NO3)2 + 4H2O + 8NO
2AgNO3 + Cu --> 2Ag + Cu(NO3)2
Cu + HgCl2 --> CuCl2 + Hg
NaOH + Cu(NO3)--> Cu(OH) + NaNO3
Cu(OH)2 + 2HCl--> CuCl2 + 2H2O
AgNO3 +HCl--> AgCl+ HNO3
1) * Trích mỗi ống nghiệm một ít hóa chất đánh dấu làm mẫu thử
- Cho một mẩu quỳ tím vào 3 mẫu thử
+ Nếu dung dịch nào làm quỳ tím ngả màu xanh là dung dich HCl
+ Nếu mẫu thử làm cho quỳ tím ngả màu đỏ là dung dịch H2SO4
- Còn lại là HNO3