

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



2 NH 3 + CO 2 → CO NH 2 2 + H 2 O
n ure = m/M = 6000000/60 = 100000 mol
n N H 3 = 100000x2/1 = 200000
V NH 3 = n.22,4 = 200000x22,4= 4480000 = 4480 ( m 3 )
n CO 2 = 100000 mol
V C O 2 = 100000 x 22,4 = 2240000l = 2240 ( m 3 )

2 NH 3 + CO 2 → CO NH 2 2 + H 2 O
Cứ 2.17 (g) NH 3 thì tạo ra 60g ure ( CO NH 2 2 )
⇒ m NH 3 = 6.2.17/60 = 3,4 (tấn)
m CO 2 = 6,44/60 = 4,4 tấn

mNH3 = 3400 (kg)
\(\Rightarrow n_{NH_3}=\dfrac{3400}{17}=200\left(kmol\right)\)
PT: \(CO_2+2NH_3\rightarrow CO\left(NH_2\right)_2+H_2O\)
Theo PT: \(n_{CO\left(NH_2\right)_2\left(LT\right)}=\dfrac{1}{2}n_{NH_3}=100\left(kmol\right)\)
\(\Rightarrow m_{CO\left(NH_2\right)_2\left(LT\right)}=100.60=6000\left(kg\right)\)
Mà: H = 97%
\(\Rightarrow m_{CO\left(NH_2\right)_2\left(TT\right)}=6000.97\%=5820\left(kg\right)\) = 5,82 (tấn)
Đáp án: C

a) \(H_2O-^{đpdd}\rightarrow H_2+\dfrac{1}{2}O_2\)
Hóa lỏng không khí (Trong công nghiệp, khí Nito được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng. Không khí sau khi đã loại bỏ CO2 và hơi nước sẽ được hóa lỏng ở áp suất cao và nhiệt độ thấp. Nâng dần nhiệt độ không khí lỏng đến -196 độ C thì nito sôi và tách khỏi được oxy vì khí oxy có nhiệt độ sôi cao hơn (-183 độ C).) => Thu được N2
\(N_2+3H_2-^{t^o,p,xt}\rightarrow2NH_3\)
\(CaCO_3-^{t^o}\rightarrow CaO+CO_2\)
\(2NH_3+CO_2-^{t^o,p}\rightarrow\left(NH_2\right)_2CO+H_2O\)
b)\(2NH_3+CO_2-^{t^o,p}\rightarrow\left(NH_2\right)_2CO+H_2O\)
\(n_{\left(NH_2\right)_2CO}=\dfrac{6.10^6}{60}=10^5\left(mol\right)\)
Ta có : \(n_{NH_3}=2n_{\left(NH_2\right)_2CO}=2.10^5\left(mol\right)\)
\(n_{CO_2}=n_{\left(NH_2\right)_2CO}=10^5\left(mol\right)\)
=> \(V_{NH_3}=2.10^5.22,4=4,48.10^6\left(lít\right)=4480\left(m^3\right)\)
\(V_{CO_2}=10^5.22,4=2,24.10^6\left(lít\right)=2240\left(m^3\right)\)

Quặng Pirit (FeS2)---------> SO2
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{SO_2}.1=\dfrac{50000}{22,4}=\dfrac{15625}{7}\Rightarrow n_{FeS_2}=\dfrac{15625}{14}\)(mol)
Vì H=95% => \(n_{FeS_2}=\dfrac{15625}{14}.\dfrac{100}{95}=1174,81\left(mol\right)\)
=> \(m_{FeS_2}=1174,81.120=140977,2\left(kg\right)\)
Vì quặng pirit chứa 98% FeS2
=> \(m_{quặng}=140977,2.\dfrac{100}{98}=143854,3\left(kg\right)\approx143,85\left(tấn\right)\)


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
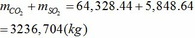
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

Tính khối lượng các chất tham gia :
Để sản xuất được 80 x 2 = 160 (tấn) NH 4 NO 3 cần 96 tấn NH 4 2 CO 3 và 164 tấn Ca NO 3 2 . Để sản xuất được 8 tấn NH 4 NO 3 cần :
96x8/160 = 4,8 tấn NH 4 2 CO 3
Và 168x8/160 = 8,2 tấn Ca NO 3 2