Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ nhất :
Số mol các chất tham gia ( 1 ) : n CaCO 3 = 20/100 = 0,2 mol bằng số mol HNO 3
Số mol các chất tham gia (2) : n MgCO 3 = 20/84 ≈ 0,24 mol nhiều hơn số mol HNO 3
Như vậy, toàn lượng HNO 3 đã tham gia các phản ứng (1) và (2). Mỗi phản ứng đều thoát ra một lượng khí CO 2 là 0,1 mol có khối lượng là 44 x 0,1 = 4,4 (gam). Sau khi các phản ứng kết thúc, 2 đĩa cân vẫn ở vị trí thăng bằng.

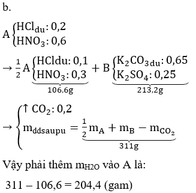
a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|

\(n_{Mg}=\dfrac{13.44}{24}=0.56\left(mol\right)\)
TN1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.56................................0.56\)
TN2 :
\(MCO_3+H_2SO_4\rightarrow MSO_4+CO_2+H_2O\)
\(x............................x\)
Vì cân thăng bằng nên :
\(m_{Mg}-m_{H_2}=m_{MCO_3}-m_{CO_2}\)
\(\Rightarrow13.44-0.56\cdot2=22-44x\)
\(\Rightarrow x=0.22\)
\(M_{MCO_3}=\dfrac{22}{0.22}=100\left(g\text{/}mol\right)\)
\(\Rightarrow M=100-60=40\left(g\text{/}mol\right)\)
\(M:Ca\)

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ hai :
Nếu mỗi cốc có 0,5 mol HNO 3 thì lượng axit đã dùng dư, do đó toàn lượng muối CaCO 3 và MgCO 3 đã tham gia phản ứng :
Phản ứng ( 1 ) : 0,2 mol CaCO 3 làm thoát ra 0,2 mol CO 2 ; khối lượng các chất trong cốc giảm : 44 x 0,2 = 8,8 (gam).
Phản ứng (2) : 0,24 mol MgCO 3 làm thoát ra 0,24 mol CO 2 ; khối lượng các chất trong cốc giảm : 44 x 0,24 = 10,56 (gam).
Sau khi các phản ứng kết thúc, hai đĩa cân không còn ở vị trí thăng bằng. Đĩa cân thêm MgCO 3 sẽ ở vị trí cao hơn so với đĩa cân thêm CaCO 3

a) a(g) vào cốc CaCO3 xảy ra phản ứng:
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
b(g) vào cốc Cu xảy ra phản ứng:
\(Cu+H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
- Ở cốc 1 khối lượng tăng lên là (56/100)a. Ở cốc b khối lượng không thay đổi nên không thể xác định tỉ lệ a/b
b) \(CaCO_3+H_2SO_4\rightarrow CaSO_4+CO_2+2H_2O\)Cu vào cốc 1 không phản ứng.
Ở cốc 2, khối lượng tăng lên là: (56/100)a(g), cốc 2 tăng lên b(g)
Để cân thăng bằng thì (56/1000a=b=>a/b=100/56


\(CaCO_3+2HNO_3\rightarrow Ca\left(NO_3\right)_2+CO_2+H_2O\)
\(MgCO_3+2HNO_3\rightarrow Mg\left(NO_3\right)_2+CO_2+H_2O\)
\(n_{CaCO3}=\frac{10}{100}=0,2\left(mol\right)\rightarrow2n_{CaCO3}< n_{HNO3}\rightarrow HNO_{3_{Du}}\)
\(\rightarrow n_{CO2}=n_{CaCO3}=0,2\left(mol\right)\)
\(m_{P_{tang}}=m_{CaCO3}-m_{CO2}=10-0,2.44=11,2\left(g\right)\)
\(n_{MgCO3}=\frac{20}{84}=0,238\left(mol\right)\rightarrow2n_{MgCO3}>n_{HNO3}\rightarrow MgCO_{3_{du}}\)
\(\rightarrow n_{CO2}=\frac{1}{2}n_{HNO3}=0,22\left(mol\right)\)
\(m_{Q_{tang}}=m_{MgCO3}-m_{CO2}=20-0,22.44=10,32\left(g\right)\)
Vì m P tăng > m Q tăng nên cân lệch vào đĩa P
Để hai cân cân bằng thì Q cần tăng thêm 11,2-10,32=0,88 gam
\(Na+H_2O\rightarrow NaOH+\frac{1}{2}H_2\)
Gọi số mol Na cần thêm là x \(\rightarrow\) nH2=0,5x
\(\rightarrow m_{ct}=23xx-0,5x=22x=0,88\rightarrow x=0,04\rightarrow m_{Na}=0,92\left(g\right)\)