Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những tính chất hoá học giống nhau : Nhôm, sắt có những tính chất hoá học của kim loại, như :
- Tác dụng với phi kim tạo oxit hoặc muối.
- Tác dụng với axit (HCl, H 2 SO 4 loãng) giải phóng khí hiđro ; Nhưng không tác dụng với H 2 SO 4 đặc, nguội và HNO 3 đặc, nguội.
- Tác dụng với dung dịch của một số muối.
(Các phương trình hoá học học sinh tự viết.)
Những tính chất hoá học khác nhau.
- Al tan trong dung dịch kiềm, Fe không tan trong dung dịch kiềm.
2Al + 2NaOH + 2 H 2 O → 2NaAl O 2 + 3 H 2
- Al tác dụng với các chất tạo hợp chất trong đó Al có hoá trị duy nhất là III, Fe tác dụng với các chất tạo hợp chất trong đó Fe có hoá trị II, hoá trị III. (Các phương trình hoá học học sinh tự viết).
- Al là kim loại hoạt động hoá học mạnh hơn Fe :
2Al + Fe 2 O 3 → 2Fe + Al 2 O 3

Chất có phản ứng thế với brom khi chiếu sáng . CH 3 - CH 2 - CH 3 ; CH 3 - CH 3
- Phản ứng thế với brom khi có mặt bột sắt và đun nóng : C 6 H 6 (benzen).
- Chất có phản ứng cộng với brom (trong dung dịch): CH 2 = CH 2 ; CH ≡CH.
Các chất tham gia phản ứng thế brom:
CH 3 - CH 2 - CH 3 + Br 2 → as CH 3 - CHCl - CH 3 (spc) + CH 3 - CH 2 - CH 2 Cl (spp) + HCl
CH 3 - CH 3 + Br 2 → as CH 3 - CH 2 Br + HBr
C 6 H 6 + Br 2 → bột Fe , t ° C 6 H 5 Br + HBr
Phản ứng cộng:
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4

- Làm mất màu dung dịch brom : CH 2 = CH 2 ; CH 2 = CH - CH 3
CH 2 = CH 2 + Br 2 → CH 2 Br - CH 2 Br
CH 2 = CH - CH 3 + Br 2 → CH 2 BrCHBr - CH 3

° Tác dụng với axit
- Muối cacbonat tác dụng với axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng khí CO2.
Na2CO3(dd) + 2HCl(dd) → 2NaCl(dd) + CO2(k) + H2O(l)
NaHCO3(dd) + HCl(dd) → NaCl(dd) + CO2(k) + H2O(l)
° Tác dụng với dung dịch bazơ
- Một số muối cacbonat tác dụng với bazơ tạo thành muối cacbonat không tan và bazơ mới
K2CO3(dd) + Ca(OH)2(dd) → CaCO3↓trắng + 2KOH(dd)
- Muối hidrocacbonat tác dụng với kiềm tạo thành dung dịch trung hòa và nước:
NaHCO3(dd) + NaOH(dd) → Na2CO3(dd) + H2O(l)
° Tác dụng với dung dịch muối
- Muối cacbonat tác dụng với dung dịch muối tạo thành hai muối mới.
Na2CO3(dd) + CaCl2(dd) → CaCO3↓trắng + 2NaCl(dd)
° Muối cacbonat bị nhiệt phân hủy
CaCO3(rắn) 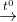 CaO(rắn) + CO2(khí)
CaO(rắn) + CO2(khí)
2NaHCO3(r) 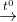 Na2CO3(r) + CO2(k) + H2O(hơi)
Na2CO3(r) + CO2(k) + H2O(hơi)

- Tác dụng với clo khi chiếu ánh sáng là CH 4 ; C 2 H 6
CH 4 + Cl 2 → CH 3 Cl + HCl
C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl

Đem nhiệt phân hỗn hợp muối thu được CO2, MgO, CaO
MgCO3 -> (t°) MgO + CO2
CaCO3 -> (t°) CaO + CO2
Thả hỗn hợp vào nước và thổi CO2 vào MgO không tan, CaO tan ta lọc lấy MgO
CaO + H2O -> Ca(OH)2
Ca(OH)2 + CO2 -> CaCO3 + H2O
CaCO3 + H2O + CO2 -> Ca(HCO3)2
Ta đem dd còn lại đi cô cạn ta được CaCO3
Ca(HCO3)2 -> (t°) CaCO3 + H2O + CO2
Đem CaCO3 đi nhiệt phân ta thu được CaO:
CaCO3 -> (t°) CaO + CO2
Đem CaO và MgO tác dụng lần lượt với dd HCl dư rồi lọc lấy MgCl2 và CaCl2 riêng biệt:
CaO + HCl -> CaCl2 + H2O
MgO + HCl -> MgCl2 + H2O

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.

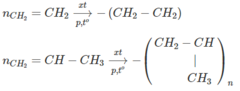
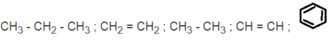

1. Tác dụng với phi kim
a) Tác dụng với oxi.
3Fe + 2O2 \(\rightarrow\) Fe3O4 (oxit sắt từ, sắt có hóa trị II và III)
b) Tác dụng với phi kim khác.
2Fe + 3Cl2 \(\rightarrow\) 2FeCl3
2. Tác dụng với dung dịch axit:
Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng Hg.
Fe + 2HCl \(\rightarrow\) FeCl2, + H2
Chú ỷ: Sắt không tác dụng với HNO3, H2S04đặc, nguội.
3. Tác dụng với dung dịch muối của kim loại yếu hơn sắt.
Fe + CuSO4 -> FeSO4 + Cu
1. Tác dụng với phi kim
a) Tác dụng với oxi.
3Fe + 2O2 → Fe3O4 (oxit sắt từ, sắt có hóa trị II và III)
b) Tác dụng với phi kim khác.
2Fe + 3Cl2 → 2FeCl3
2. Tác dụng với dung dịch axit: Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng Hg.
Fe + 2HCl → FeCl2, + H2
*Chú ý: Sắt không tác dụng với HN03, H2S04đặc, nguội.
3. Tác dụng với dung dịch muối của kim loại yếu hơn sắt.
Fe + CuSO4 -> FeSO4 + Cu