Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = 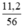 = 0,2 mol.
= 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol)
b) nCaO = 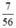 = 0,125 (mol)
= 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (lít)
d) nCO2 = 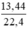 = 0,6 (mol)
= 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)

a, CaCO3 --t0--> CaO + CO2
b, Ta có nCO2= 5,6/22,4=0,25 = nCaCO3
=> mCaCO3= 0,25.100=25 g
c, nCaO = nCO2=0,25
=> mCaO= 0,25.56=14 g

Đáp án
Vì khi nung ( C a C O 3 ) , khí C O 2 thoát ra nên khối lượng chất rắn thu được sau phản ứng giảm. Phương trình hóa học :
C a C O 3 → t ° C a O + C O 2

\(CaCO_3 \to CaO+CO_2\\ BTKL:\\ m_{CaCO_3}=m_{CaO}+m_{CO_2}\\ 150=m_{CaO}+66\\ \to m_{CaO}=84(g)\)

Khi nung đá vôi thì tạo ra lượng khí C O 2 đáng kể thoát ra ngoài nên làm khối lượng sản phẩm phản ứng giảm.

\(n_{CaO}=\dfrac{m}{M}=0,2\left(mol\right)\)
\(PTHH:CaCO_3\rightarrow CaO+CO_2\)
.................0,2............0,2......0,2..........
a, \(m_{CaCO_3}=M.n=20\left(g\right)\)
b, \(V_{CO_2}=n.22,4=4,48\left(l\right)\)
Vậy ...

PTHH: \(CaCO_3\overset{t^o}{--->}CaO+CO_2\)
Áp dụng định luật bảo toàn khối lượng, ta được:
\(m_{CaCO_3}=m_{CaO}+m_{CO_2}=560+440=1000\left(g\right)=1\left(kg\right)\)
Vậy khối lượng CaCO3 đã dùng là 1 kg

\(CaCO_3\rightarrow\left(t^o\right)CaO+CO_2\\ n_{CaCO_3}=\dfrac{200}{100}=2\left(mol\right)\\ n_{CaO}=\dfrac{100,8}{56}=1,8\left(mol\right)\\ V\text{ì}:\dfrac{2}{1}>\dfrac{1,8}{1}\Rightarrow CaCO_3d\text{ư}\\ n_{CaCO_3\left(p.\text{ứ}\right)}=n_{CaO}=1,8\left(mol\right)\\ m_{CaCO_3\left(d\text{ư}\right)}=200-1,8.100=20\left(g\right)\)

a) \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Ta có: \(n_{CaCO_3}=n_{CaO}=0,2\left(mol\right)\)
b) \(n_{CaO}=\dfrac{7}{56}=0,125\left(mol\right)\)
Ta có : \(n_{CaCO_3}=n_{CaO}=0,125\left(mol\right)\)
=> \(m_{CaCO_3}=0,125.100=12,5\left(g\right)\)
c) \(n_{CO_2}=n_{CaCO_3}=3,5\left(mol\right)\)
=> \(V_{CO_2}=3,5.22,4=78,4\left(lít\right)\)
d) \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Ta có: \(n_{CO_2}=n_{CaCO_3}=n_{CaO}=0,6\left(mol\right)\)
=> \(m_{CaCO_3}=0,6.100=60\left(g\right)\)
\(m_{CaO}=0,6.56=33,6\left(g\right)\)



nCaO = 5,6 : 56 =0,1(mol)
PTHH : CaCO3 -t--> CaO +CO2
0,1(mol)<---------0,1
b ) nCaCO3= 25:100=0,25(mol)
theo pt trên nCaO = nCO2 = nCaCO3=0,25(mol)
=> mCaO = 0,25.56 =14(g)
=> V CO2 = 0,25 . 22,4 = 5,6 (L)
a) PTHH: CaCO3 \(\underrightarrow{t^o}\) CaO + CO2 (1)
1 1 1
0,1 0,1 0,1
nCaO = \(\dfrac{m}{M}\) = \(\dfrac{5,6}{56}\) = 0,1 (mol)
Từ (1) ⇒ 0,1 mol CaO ................... 0,1 mol CaCO3
Vậy cần 0,1 mol CaCO3 để điều chế được 5,6g CaO.
b) nCaCO3 = \(\dfrac{m}{M}\) = \(\dfrac{25}{100}\) = 0,25 (mol)
Từ (1) ⇒ 0,25 mol CaCO3 ................... 0,25 mol CaO
mCaO = n.M = 0,25 . 56 = 14 (g)
Từ (1) ⇒ 0,25 mol CaCO3 ................... 0,25 mol CO2
mCO2 = n.M = 0,25 . 44 = 11 (g)
VCO2 = 22,4 . m = 22,4 . 11 = 246,4 (l)