Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
16HCl + 2KMnO4→ 5Cl2+ 2MnCl2+ 2KCl+8H2O
m/15 → m/63,2
6HCl + KClO3 →3Cl2+ KCl+3H2O
m/122,5→ m/40,8
4HCl + MnO2→ Cl2+ MnCl2+ 2H2O
m/87 → m/87
So sánh thấy nếu lấy cùng 1 lượng các chất phản ứng với HCl thì KClO3 cho nhiều khí Cl2 nhất

a) Giả sử lấy lượng mỗi chất là a gam
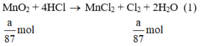
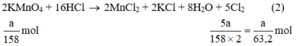
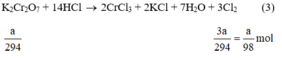
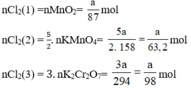
Ta có: 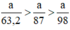
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 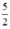 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

Trong phản ứng với HCl đặc thì chất nào nhận electron nhiều nhất thì cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
Vậy chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Đáp án B.

Chọn đáp án C
C a O C l 2 + 2HCl → C a C l 2 + C l 2 + H 2 O
1 1 mol
2 K M n O 4 + 16HCl → 2KCl + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
1 2,5 mol
K 2 C r 2 O 7 + 14HCl → 2KCl + 2 C r C l 3 + 3 C l 2 + 7 H 2 O
1 3 mol
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
1 1 mol
Vậy nếu cho cùng 1 mol mỗi chất C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , MnO2 thì K 2 C r 2 O 7 cho lượng khí C l 2 nhiều nhất.

Giả sử các chất đều có số mol = 1
- Với MnO2:
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
1-------------->0,25
- Với KMnO4
PTHH: 2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
1-------------------------->0,3125
- Với Al:
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
1----------------------->1,5
- Với KClO3
PTHH: KClO3 + 6HCl --> KCl + 3Cl2 + 3H2O
1------------->0,5
=> Al cho thể tích khí lớn nhất
Gọi số mol mỗi chất là a mol.
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(\dfrac{a}{87}\) \(\dfrac{a}{87}\)
\(KMnO_4+8HCl\rightarrow MnCl_2+KCl+H_2O+\dfrac{5}{2}Cl_2\)
\(\dfrac{a}{158}\) \(\dfrac{5a}{316}\)
\(Al+3HCl\rightarrow AlCl_3+\dfrac{3}{2}H_2\)
\(\dfrac{a}{27}\) \(\dfrac{a}{18}\)
\(KClO_3+6HCl\rightarrow KCl+3H_2O+3Cl_2\)
\(\dfrac{a}{122,5}\) \(\dfrac{6a}{245}\)
Ta có: \(\dfrac{a}{18}>\dfrac{a}{63,2}>\dfrac{a}{87}>\dfrac{6a}{245}\)
Nếu cùng số mol thì \(Al\) thu được thể tích khí nhiều nhất

1)
| CaOCl2 | + | 2HCl | → | Cl2 | + | H2O | + | CaCl2 |
| 16HCl | + | 2KMnO4 | → | 5Cl2 | + | 8H2O | + | 2KCl | + | 2MnCl2 |
| 14HCl | + | K2Cr2O7 | → | 3Cl2 | + | 7H2O | + | 2KCl | + | 2CrCl3 |
| 4HCl | + | MnO2 | → | Cl2 | + | 2H2O | + | MnCl2 |
Theo pt:
-1mol CaOCl2 sẽ tạo ra 1mol Cl2
-1mol KMnO4 sẽ tạo ra 2,5mol Cl2
-1mol K2Cr2O7 sẽ tạo ra 3mol Cl2
-1mol MnO2 sẽ tạo ra 1mol Cl2
Vậy K2Cr2O7 tạo ra lượng khí clo nhiều nhất,CaOCl2 và MnO2 tạo ra lượng khí clo ít nhất
Theo đề, ta có: \(n_{CaOCl_2}=\dfrac{100}{127}\left(mol\right)\\ n_{KMnO_4}=\dfrac{100}{158}=\dfrac{50}{79}\left(mol\right)\\ n_{K_2Cr_2O_7}=\dfrac{100}{294}=\dfrac{50}{147}\left(mol\right)\\ n_{MnO_2}=\dfrac{100}{87}\left(mol\right)\)|
\(CaOCl_2+2HCl\rightarrow Cl_2+H_2O+CaCl_2\)
\(16HCl+2KMnO_4\rightarrow5Cl_2+8H_2O+2KCl+2MnCl_2\)
\(14HCl+K_2Cr_2O_7\rightarrow3Cl_2+7H_2O+2KCl+2CrCl_3\)
\(4HCl+MnO_2\rightarrow MnCl_2+2H_2O\)
Theo phương trình:
- \(\dfrac{100}{127}mol\) CaOCl2 sẽ tạo ra \(\dfrac{100}{127}mol\) Cl2.
- \(\dfrac{100}{158}mol\) KMnO4 sẽ tạo ra \(\dfrac{125}{79}mol\) Cl2.
- \(\dfrac{100}{294}mol\) K2Cr2O7 sẽ tạo ra \(\dfrac{50}{49}mol\) Cl2.
- \(\dfrac{100}{87}mol\) MnO2 sẽ tạo ra \(\dfrac{100}{87}mol\) Cl2.
Vậy 100(g) KMnO4 sẽ tạo ra lượng Cl2 nhiều nhất, 100(g) CaOCl2 sẽ tạo ra lượng Cl2 ít nhất.


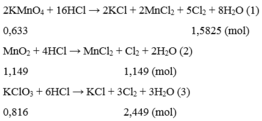

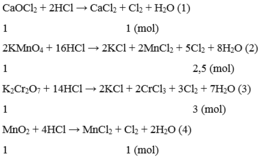


Coi \(n_{KMnO_4} = n_{MnO_2} = 1(mol)\)
\(2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O(1)\\ MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O(2)\\ n_{Cl_2(1)} = \dfrac{5}{2}n_{KMnO_4} =2,5(mol)\\ n_{Cl_2(2)} = n_{MnO_2} = 1(mol)\\ \)
Vì : \(n_{Cl_2(1)} > n_{Cl_2(2)}\) nên KMnO4 sinh ra nhiều Clo hơn