Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


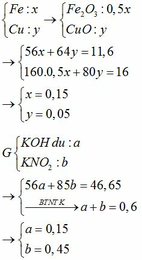
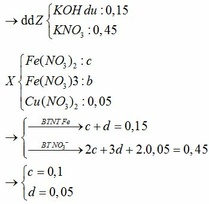

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
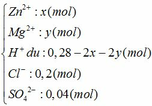
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
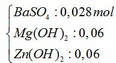
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
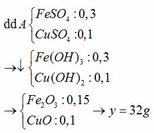

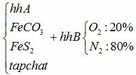
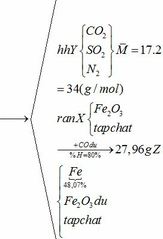
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
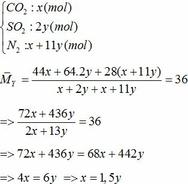
Khối lượng Fe có trong Z là:
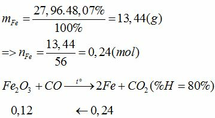
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
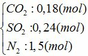
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
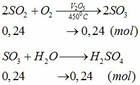
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
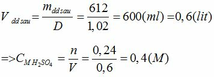

* tac dung voi NaỌH:
Al + NaOH + 3H2O --> Na[Al(OH)4] + 3/2H2
nH2 = 0,12 mol => nAl = 0,08 mol.
* Khi cho them HCl:
FeCO3 + 2HCl ---> FeCl2 + H2O + CO2 (1)
CO2 + Ca(OH)2 --> CaCO3 + H2O
=> n(ket tua) = 0,1 => nCO2 = 0,1 mol.=> nHCl(1) = 0,2 mol
=> n(FeCO3) = nCO2 = 0,1 mol
Fe + 2HCl ---> FeCl2 + H2
*Rắn C chinh ka Cu:
Cu + 4HNO3 ---> Cu(NO3)2 + 2NO2 + 2H2O
n(NO2) = 0,05 mol => nCu = 0,025 mol.
* Cho NaOH dư vao dd D:
Cu(NO3)2 + 2NaOH ---> Cu(OH)2 + 2NaNO3
Cu(OH)2 -------------t0-----> CuO + H2O
nCuO = nCu = 0,025 mol
=> mCuO = 80*0,025 = 2gam.
* Khoi luong cac chat trong hon hop A là:
mAl = 27*0,08 = 2,16 gam.
mFeCO3 = 0,1 * 116 = 11,6 gam
mCu = 64* 0,025 = 1,6 gam.
mFe = 20 - (mFeCO3 + mAl + mCu) = 4,64 gam.


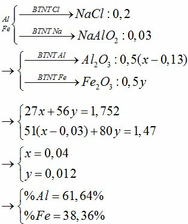



bạn dò lại đề kĩ xem.
Đúng mà, không sai đâu