Câu 1: Các nguyên tử có thể tạo thành cation đơn nguyên tử.
A. 11Na, 13Al, 17Cl B. 16S, 15P, 17Cl C. 3Li, 11Na, 13Al D. 16S, 15P, 11Na
Câu 2: Các nguyên tử có thể tạo thành anion đơn nguyên tử.
A. 12Mg, 4Be, 11Na B. 16S, 15P ,13Al C. 16S, 15P ,17Cl D. 16S, 11Na ,17Cl
Câu 3: Nguyên tử có số hiệu 20, khi tạo thành liên kết hóa học sẽ
A. mất 2e tạo thành ion có điện tích 2+. B. nhận 2e tạo thành ion có điện tích 2-.
C. góp chung 2e tạo thành 2 cặp e chung. D. góp chung 1e tạo thành 1 cặp e chung.
Câu 4: Nguyên tử X có số hiệu nguyên tử là 12, nó có khả năng tạo thành ion:
A. X- B. X+ C. X2- D. X2+
Câu 5: Chất chỉ chứa ion đa nguyên tử là
A. KCl B. Na2SO4 C. NH4Br D. NH4NO3
Câu 6: Nguyên tử nào sau đây có cấu hình e giống O2- (Z=8)
A. N (Z=7) B. F(Z=9) C. Ne(Z=10) D. C(Z=6)
Câu 7: Ion X- có cấu hình e giống Ar.vậy X là
A. F B. Cl C. Br D. F
Câu 8: Ion X-(Z=9), có cấu hình e giống
A. O2- (Z=8), Ne(Z=10) B. Na+(Z=11), Al3+(Z=13)
C. cả A và B đều đúng D. tất cả đều sai
Câu 9: Tổng số hạt có trong ion K+ là
A. 57 B. 58 C. 38 D. 59
Câu 10: Tìm định nghĩa sai về liên kết ion
A. Liên kết ion được hình thành bởi lực hút tĩnh điện giữa 2 ion mang điện trái dấu
B. Liên kết ion trong tinh thể NaCl là lực hút tĩnh điện giữa Na+ và Cl-
C. Liên kết ion là liên kết được hình thành do sự tương tác giữa các ion cùng dấu
D. Liên kết ion là liên kết giữa 2 nguyên tố có độ âm điện > 1,7
Câu 11: Trong dãy oxit sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Những oxit có liên kết ion là
A. Na2O, SiO2, P2O5 B. Na2O, MgO, Al2O3
C. MgO, Al2O3, P2O5 D. SO3, Cl2O7, Na2O
Câu 12: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử
A. phi kim, được tạo thành do sự góp chung electron.
B. khác nhau, được tạo thành do sự góp chung electron.
C. được tạo thành do sự góp chung 1 hay nhiều electron.
D. được tạo thành từ sự cho nhận electron giữa chúng.
Câu 13. Cho cấu hình electron sau: 1s22s22p6. Hãy cho biết có bao nhiêu ngtử hoặc ion có cấu hình electron như trên?
A. 3 B. 5 C. 7 D. 6
Câu 14: Bản chất của liên kết ion là lực hút tĩnh điện giữa
A. 2 ion. B. 2 ion dương và âm.
C. nhân và các e hóa trị. D. các hạt mang điện trái dấu.
Câu 15: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình. B. phi kim điển hình.
C. kim loại và phi kim. D. kim loại điển hình và phi kim điển hình.
Câu 16. Cặp nguyên tố nào sau đây sẽ tạo thành hợp chất ion:
A. C và S B. S và H C. H và O; D. O và Na
Câu 17: Trong các hợp chất sau đây: HCl, NaF, H2O và NH3. Hợp chất có liên kết ion là
A. H2O B. HCl C. NaF D. NH3
Câu 18: Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion ?
A. H2S, NH3. B. BeCl2, BeS. C. MgO, Al2O3. D. MgCl2, AlCl3.
Câu 19: Cho các phân tử sau: LiCl, NaCl, KCl, RbCl, CsCl liên kết trong phân tử mang nhiều tính ion nhấtlà
A. CsCl B. LiCl và NaCl C. KCl D. RbCl
Câu 20: Nhóm hợp chất nào sau đây đều là hợp chất ion ?
A. H2S, Na2O. B. CH4, CO2. C. CaO, NaCl. D. SO2, KCl.
Câu 21: Xét oxit các nguyên tử thuộc chu kì 3, oxit có liên kết ion là
A. Na2O, MgO, Al2O3. B. SiO2, P2O5, SO3.
C. SO3, Cl2O7, Cl2O D. Al2O3, SiO2, SO2.
Câu 22: Cấu hình electron ở lớp ngoài cùng của các nguyên tố là ns2np5. Liên kết của các nguyên tố này với nguyên tố hiđro thuộc loại liên kết nào sau đây?
A. Liên kết cộng hoá trị không cực. B. Liên kết cộng hoá trị có cực.
C. Liên kết ion. D. Liên kết tinh thể.
Câu 23: a. Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là
A. XY, liên kết ion B. X2Y , liên kết ion
C. XY, liên kết cộng hóa trị có cực D. XY2, liên kết cộng hóa trị có cực
b. Trong các nhóm A (trừ nhóm VIIIA) theo chiều tăng dần của điện tích hạt nhân thì
A. tính phi kim tăng, độ âm điện giảm B. tính kim loại tăng, độ âm điện giảm
C. tính kim loại tăng; I1 tăng D. tính phi kim tăng, bán kính nguyên tử tăng
Câu 24: Liên kết cộng hóa trị có cực tạo thành giữa hai nguyên tử
A. phi kim khác nhau. B. cùng một phi kim điển hình.
C. phi kim mạnh và kim loại mạnh. D. kim loại và kim loại.
Câu 25: Chọn hợp chất có liên kết cộng hóa trị.
A. NaCl, CaO. B. HCl, CO2. C. KCl, Al2O3. D. MgCl2, Na2O.
Câu 26. Dãy các hợp chất nào sau đây chỉ chứa các hợp chất có liên kết cộng hóa trị:
A. BaCl2; CuCl2; LiF B. H2O; SiO2; CH3COOH
C. Na2O; Fe(OH)3 ; HNO3 D. NO2 ; HNO3 ; NH4Cl
Câu 27: Loại liên kết trong phân tử khí hiđroclorua là liên kết
A. cho – nhận. B. cộng hóa trị có cực. C. ion D. cộng hóa trị không cực.
Câu 28: Phân tử nào có liên kết cộng hóa trị không cực ?
A. HCl B. Cl2 C. NH3 D. H2O
Câu 29: Liên kết nào phân cực nhất ?
A. H2O B. NH3 C. NCl3 D. CO2
Câu 30: Cho các oxit: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.Dãy các hợp chất trong phân tử chỉ gồm liên kết cộng hoá trị
A. SiO2, P2O5, SO3, Cl2O7 B. SiO2, P2O5, Cl2O7, Al2O3
C. Na2O, SiO2, MgO, SO3 D. SiO2, P2O5, SO3, Al2O3
Câu 31: Dãy phân tử nào cho dưới đây đều có liên kết cộng hoá trị không phân cực?
A. N2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl. C. N2, HI, Cl2,CH4. D. Cl2,O2.N2,F2
Câu 32.Dãy các chất nào chỉ chứa liên kết đơn?
A. C2H4 ; C2H6. B. CH4 ; C2H6. C. C2H4 ; C2H2. D. CH4 ; C2H2.
Câu 33: Cho các phân tử các chất CaO, CH4, CO2, NH3, Na2O, KCl. Tổng số các chất có liên kết ion là
A 5 B. 4 C. 3 D. 2
Câu 34: Dãy gồm các chất mà phân tử có liên kết cộng hóa trị là:
A. NaOH; HCl, MgO B. Na2SO4; KBr; SO2.
C. CO2; HCl, H2O D. H2CO3, CaO; HF.
Câu 35. Tổng số hạt electron trong cation  là : ( Biết
là : ( Biết 
 )
)
A. 15 B. 10 C. 12 D. 11
Câu 36: Trong các chất sau đây, chất nào có liên kết cộng hoá trị? 1. H2S ; 2. SO2 ; 3. NaCl ; 4. CaO; 5. NH3 ; 6. HBr ; 7. H2SO4 ; 8. CO2 ; 9. K2S
A. 1, 2, 3, 4, 8, 9 B. 1, 4, 5, 7, 8, 9 C. 1, 2, 5, 6, 7, 8 D. 3, 5, 6, 7, 8, 9
Câu 37: Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là
A. 2 và 1. B. 2+ và 1-. C. +2 và -1. D. 2+ và 2-
Câu 38: Chọn câu sai:
A. Điện hóa trị có trong hợp chất ion.
B. Điện hóa trị bằng số cặp e dùng chung.
C. Cộng hóa trị có trong hợp chất cộng hóa trị.
D. Cộng hóa trị bằng số cặp e dùng chung.
Câu 39: liên kết cộng hóa trị là
A. liên kết giữa các phi kim với nhau
B. liên kết trong đó cặp e chung bị lệch về một nguyên tử
C. liên kết được hình thành do sự dùng chung e của 2 nguyên tử khác nhau
D. liên kết được tạo nên giữa 2 nguyên tử bằng những e chung
Câu 40: Liên kết trong phân tử H2 là liên kết
A. hiđro B. cộng hóa trị C. ion D. cho nhận
Câu 41: Câu đúng khi nói về tính chất của hợp chất cộng hóa trị
A. thường không dẫn điện B. thường ít tan trong nước
C. nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp D. cả A, B, C
Câu 42. Cho các phân tử sau : C2H4, C2H2, O3, N2, CO2, CH4, NH3. Có bao nhiêu phân tử có liên kết đôi và có bao nhiêu phân tử có liên kết ba?
A. 2 và 2. B. 3 và 2. C. 3 và 1. D. 2 và 1.
Câu 43: Hoá trị trong hợp chất ion được gọi là
A. Điện hoá trị. B. Cộng hoá trị. C. Số oxi hoá. D. Điện tích ion.
Câu 44: Điện hóa trị của canxi và oxi trong hợp chất CaO lần lượt là
A. 2+, 1-. B. 1+, 2-. C. 1+, 1-. D. 2+, 2-.
Câu 45: Nguyên tố X, Y có số hiệu nguyên tử lần lượt là 20 và 9. Công thức hợp chất tạo bởi X và Y, thuộc loại liên kết gì?
A. X2Y, liên kết CHT. B. XY2, liên kết ion.
C. X2Y, liên kết ion. D. XY, liên kết CHT.
Câu 46: Biết độ âm điện của F, O, Cl, N lần lượt là: 3,98; 3,44; 3,16; 3,04. Hợp chất có độ phân cực mạnh nhất là
A. F2O B. NO C. ClF D. NCl3
Câu 47: Biết độ âm điện của F, O, Cl, N lần lượt là: 3,98; 3,44; 3,16; 3,04. Hợp chất có độ phân cực yếu nhất là
A. Cl2O B. NF C. ClF D. NCl3
Câu 48: Cho các nguyên tố X (Z=9), Y (Z=19), Z (Z=8), kiểu liên kết hóa học có thể có giữa các cặp X và Y; X và Z là
A. giữa X và Y là liên kết ion; giữa X và Z là liên kết cộng hóa trị
B. giữa X và Y là liên kết cộng hóa trị; giữa X và Z là liên kết ion
C. tất cả đều là liên kết ion
D. tất cả đều là liên kết cộng hóa trị
Câu 49: Cho độ âm điện của các nguyên tố như sau:
Nguyên tố | K | Na | Ca | Ba | Al | Fe | H | C | N | O | S | Cl |
Độ âm điện (X) | 0,82 | 0,93 | 1,0 | 0,89 | 1,61 | 1,83 | 2,2 | 2,55 | 3,04 | 3,44 | 2,558 | 3,16 |
a) Các hợp chất chỉ có liên kết ion là
A. SO2, SCl2 B. K2S, Cl2O7 C. Al2S3, AlCl3 D. Al2O3, KCl, K2S
b) Các hợp chất chỉ chứa liên kết cộng hóa trị phân cực là
A. Na2S, AlCl3 B. BaCl2, KCl C. NaCl, Al2S3 D. Cả A, B, C đều sai
BÀI TẬP
Bài 1: Tính tổng số electron và tổng số hạt proton của các ion sau:  ,
, ,
, ,
, ,
, ,
, ,
, ,
,
Bài 2: Ion  có tổng số hạt proton là 31 hạt
có tổng số hạt proton là 31 hạt
a. Xác định số hiệu nguyên tử của X và cho biết vị trí X trong BTH
b. Viết sơ đồ và PTHH tạo thành phân tử Na3X
Bài 3: Ion  có tổng số hạt electron là 50 hạt
có tổng số hạt electron là 50 hạt
a. Xác định số hiệu nguyên tử của Y và cho biết vị trí Y trong BTH
b. Viết sơ đồ và PTHH tạo thành phân tử MgY
Bài 4: Ion  có tổng số hạt mang điện là 62 hạt. Xác định số hiệu nguyên tử và cho biết vị trí X trong bảng tuần hoàn.
có tổng số hạt mang điện là 62 hạt. Xác định số hiệu nguyên tử và cho biết vị trí X trong bảng tuần hoàn.





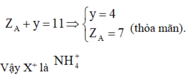
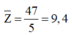
![]()



A
A