Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
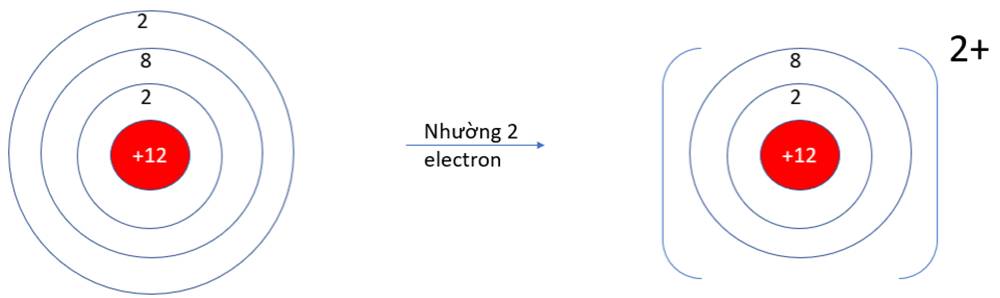
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

Đáp án C
Hướng dẫn ![]() => A.x = 7y (1)
=> A.x = 7y (1)
M = ![]() = 46 => A.x + 16.y = 46 (2)
= 46 => A.x + 16.y = 46 (2)
Từ (1) và (2) => y=2 => A.x = 14
Với x=1 thỏa mãn A = 14 (N) => Hợp AxOY là NO2
Các phát biểu 1, 2, 4 đúng

Chọn đáp án C
1. Bán kính của S lớn hơn bán kính F. Chuẩn
2. Tính khử và tính oxi hóa của HBr đều mạnh hơn HF. Sai tính oxh của HF max
3. Có 2 HX ( X: halogen ) có thể điều chế bằng cách cho NaX tác dụng với dung dịch H2SO4 đậm đặc.
Chuẩn đó là HCl và HF (HI và HBr không điều chế được vì phản ứng với H2SO4 đậm đặc)
4. Tính khử của I- mạnh hơn F-. Chuẩn
5. Trong công nghiệp, người ta không sản xuất các khí SO2, H2S.Chuẩn
6. Tất cả các halogen đều không có ở dạng đơn chất trong thiên nhiên. Chuẩn
7. Để thu được dung dịch H2SO4, trong công nghiệp, người ta cho nước vào oleum
Sai.Phải cho ngươc lại (oleum vào nước)

a) Trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử của nguyên tố giảm dần \(\Rightarrow Z_X< X_Y\).
-Vì 2 nguyên tố X,Y đứng kế nhau trong bảng tuần hoàn nên \(Z_X+1=Z_Y\left(1\right)\)
-Vì 2 nguyên tố X,Y có tổng số hạt mang điện là 58 nên \(2\left(Z_X+Z_Y\right)=58\left(2\right)\)
Từ (1), (2) ta có: \(\left\{{}\begin{matrix}Z_X=14\\Z_Y=15\end{matrix}\right.\)
Cấu hình electron của nguyên tử X,Y:
\(X:1s^22s^22p^63s^23p^2\) ; \(Y:1s^22s^22p^63s^23p^3\)
b) Vị trí của X,Y trong bảng tuần hoàn:
X: ô 14, nhóm IVA, chu kì 3. X là Si.
Y: ô 15, nhóm VA, chu kì 3. Y là P.



Đáp án B.
Cation có số electron nhỏ hơn so với nguyên tử, lực hút giữa hạt nhân và các electron mạnh hơn, làm bán kính giảm. Anion có số electron lớn hơn số electron của nguyên tử, lực hút của hạt nhân với các electron yếu hơn, làm tăng bán kính.