Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng của 1,00 lit nước là:
m = D.V = 1,00.1000 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18(100 - 25) = 313500(J) = 313,5 KJ
Đó là nhiệt lượng mà khí metan khi đốt cháy cần phải toả ra.
Khối lượng metan cần phải đốt cháy là:
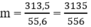
Số mol metan cần phải đốt cháy là:
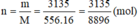
Vậy thể tích khí metan (đktc) cần phải đốt cháy là:
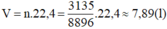

Khối lượng của 1,00 lit nước là:
m = D.V = 1,00g/cm3.1000cm3 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18(100 - 25) = 313.500(J)
Đó là nhiệt lượng mà khí metan khi đốt cháy cầ phải toả ra.
Khối lượng metan cần phải đốt cháy là:

Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103) = 33 440 000 (J) = 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ; nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là: 880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là: 15600.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên cần dùng là:
36,991.22,4 = 828,6 (lít) (đktc)

1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
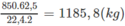
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
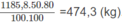
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
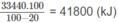

Đáp án C
Nhận thấy đốt cháy X tương đương đốt cháy metan
→ nCH4 = nO2 : 2 = 0,15 mol
Luôn có mCH4 = mX→ nX =
0
,
15
.
16
4
,
8
.
2
= 0,25 mol
nX - nCH4 = nCH4 pư → nCH4 pứ = 0,1 mol
Vậy H =
0
,
1
0
,
15
×100% = 66,67%.

đáp án A
Ta có: nCO2 = nH2O = 0,03 mol
⇒ nC = 0,03 và nH = 0,06 mol
⇒ mC + mH = 0,42 < 0,74 gam ⇒ mO/X = 0,32 gam ⇒ nO/X = 0,02 mol.
⇒ nC : nH : nO = 0,03 : 0,06 :0,02 = 3 : 6 : 2
+ Vì công thức nguyên của X ≡ CTPT là C3H6O2.
+ Ta có nX = 0,74 : 74 = 0,01 mol.
⇒ nNaOH pứ = 0,01 mol ⇒ nNaOH dư = 0,09 mol.
+ Bảo toàn khối lượng ta có: mChất rắn = 0,74 + 1,03×100 – 99,32 = 4,42 gam.
⇒ mMuối/Y = 4,42 – 0,09×40 = 0,82 gam.
⇒ MMuối = 0,82 ÷ 0,01 = 82 ⇔ MRCOONa = 82 ⇔ R = 15
⇒ Muối đó là CH3COONa ⇒ X là CH3COOCH3.
⇒ Chọn A

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.





Nhiệt độ của 1,00 g nước lên 1oC cần tiêu tốn nhiệt lượng là 4,18 J.
Vậy khi nâng nhiệt độ 1,00 g H2O từ 25,0oC lên 100oC cần tiêu tốn nhiệt lượng là: 75,0 x 4,18 = 314 (J)
Do đó, nhiệt lượng cần tiêu tốn cho 1,0 lít nước từ 25,0oC lên 100oC là:
314 x 1,00 x 103 = 314 x 103 = 314 kJ
Mặt khác: 1g CH4 khi cháy tỏa ra 55,6 kJ
Vậy để có 314 kJ cần đốt cháy lượng CH4 là : = 5,64 g
= 5,64 g
Từ đó thể tích CH4 (đktc) cần phải đốt là: x 22,4 ≈ 7,90 lít
x 22,4 ≈ 7,90 lít
Xem thêm tại: http://loigiaihay.com/bai-4-trang-123-sgk-hoa-hoc-lop-11-c54a8718.html#ixzz4BuiQ9QhC
Nhiệt độ của 1,00 g nước lên 1oC cần tiêu tốn nhiệt lượng là 4,18 J.
Vậy khi nâng nhiệt độ 1,00 g H2O từ 25,0oC lên 100oC cần tiêu tốn nhiệt lượng là: 75,0 x 4,18 = 314 (J)
Do đó, nhiệt lượng cần tiêu tốn cho 1,0 lít nước từ 25,0oC lên 100oC là:
314 x 1,00 x 103 = 314 x 103 = 314 kJ
Mặt khác: 1g CH4 khi cháy tỏa ra 55,6 kJ
Vậy để có 314 kJ cần đốt cháy lượng CH4 là : = 5,64 g
= 5,64 g
Từ đó thể tích CH4 (đktc) cần phải đốt là: x 22,4 ≈ 7,90 lít
x 22,4 ≈ 7,90 lít