Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(1)n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\)
Từ giả thiết và theo PT:
\(\begin{cases} 24n_{Mg}+56n_{Fe}=5,2\\ n_{Mg}+n_{Fe}=0,15 \end{cases}\\ \Rightarrow n_{Mg}=0,1(mol);n_{Fe}=0,05(mol)\)
\(\Rightarrow \begin{cases} \%m_{Mg}=\dfrac{0,1.24}{5,2}.100\%=46,15\%\\ \%m_{Fe}=100-46,15=53,85\% \end{cases}\\ 2)\Sigma n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,3}{1}=0,3(l)=300(ml)\)
lười làm thì đừng làm
box hóa có luật không tham khảo rồi

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

nH2 = 13,44/22,4 = 0,6 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
nHCl = 0,6 . 2 = 1,2 (mol)
mHCl = 1,2 . 36,5 = 43,8 (g)
nMg = 0,6 (mol)
mMg = 0,6 . 24 = 14,4 (g)
Không thấy mhh để tính%

PTHH: Mg + 2HCl \(\rightarrow\)MgCl2 + H2(1)
Fe + 2HCl \(\rightarrow\)FeCl2 + H2 (2)
Có nH2=\(\dfrac{3,36}{22,4}\)=0,15 mol
gọi nH2(PT1)=a
nH2(PT2)=b
=> a+b=0,15 <=> a=0,15-b
Theo PT1: nMg=nH2(Pt1)=a mol
Theo PT2:n Fe=nH2(PT2)=b mol
Có mMg+mFe=5,2g
=> 24a+56b=5,2
<=>24(0,15-b)+56b=5,2
<=> b=0,05 mol
=> mFe=0,05.56=2,8 g
=>%mFe=\(\dfrac{2,8}{5,2}\).100%=53,85%
=>%mMg=100%-53,85%=46,15%
b) Theo PT1 và PT2 : nHCl=2nH2=0,15.2=0,3 mol
Có VddHCl=\(\dfrac{nHCl}{CM}\)=0,3l=300ml

\(n_{Zn} = a(mol) ; n_{Al} = b(mol) ; n_{Mg} = c(mol)\\ \Rightarrow 65a + 27b + 24c = 44,1(1)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3 H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{31,36}{22,4} = 1,4(2)\\ Mà : 2a = 3b(3)\\ (1)(2)(3) \Rightarrow a = 0,3 ; b = 0,2 ; c = 0,8\\ \%m_{Zn} = \dfrac{0,3.65}{44,1}.100\% = 44,22\%\\ \%m_{Al} = \dfrac{0,2.27}{44,1}.100\% = 12,24\%\)
\(\%m_{Mg} = 100\% -44,22\% -12,24\% = 43,54\%\)

Gọi nFe = a (mol); nAl = b (mol)
=> 56a + 27b = 11 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> 2a ---> a ---> a
2Al + 6HCl -> 2AlCl3 + 3H2
b ---> 1,5b ---> b ---> b
=> a + 1,5b = 0,4 (2)
Từ (1)(2) => a = 0,1 (mol); b = 0,15 (mol)
mFe = 0,1 . 56 = 5,6 (g)
mAl = 0,2 . 27 = 5,4 (g)
THAM KHẢO :
Fe + 2HCl -> FeCl2 + H2 (1)
a) 2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Gọi khối lượng Fe là x(g) (0<x<11) => nFe = x/56 (mol)
Thì mAl là 11-x(g) => nAl = (11-x)/27 (mol)
nH2 = 8,96/22,4 = 0,4 (mol)
Theo PT (1) ta có: nH2 = nFe = x/56 (mol)
Theo PT (2) ta có: nH2 = 3/2 nAl = 3/2 . (11-x)/27 = (11-x)/18 (mol)
Theo đề bài, nH2 thu được là 0,4(mol) nên ta có:
x/56 + (11-x)/18 = 0,4
<=> 18x +56(11-x) = 403,2
<=> x = 5,6 (g)
Do đó: mFe = 5,6(g) => nFe = 5,6/56 = 0,1 (mol)
mAl = 11-5,6 = 5,4(g) => nAl = 5,4/27 = 0,2 (mol)

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
a) Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=n_{Mg}\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,5\cdot24}{16}=75\%\) \(\Rightarrow\%m_{MgO}=25\%\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Mg}=0,5\left(mol\right)\\n_{MgO}=\dfrac{16\cdot25\%}{40}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=2n_{Mg}+2n_{MgO}=1,2\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{1,2\cdot36,5}{20\%}=219\left(g\right)\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,5\left(mol\right)\\n_{MgCl_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{H_2}=0,5\cdot2=1\left(g\right)\\m_{MgCl_2}=0,6\cdot95=57\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{hhA}+m_{ddHCl}-m_{H_2}=234\left(g\right)\) \(\Rightarrow C\%_{MgCl_2}=\dfrac{57}{234}\cdot100\%\approx24,36\%\)
Cho mình hỏi ở cái PTHH ấy! sao ta không tính số mol ở dưới??

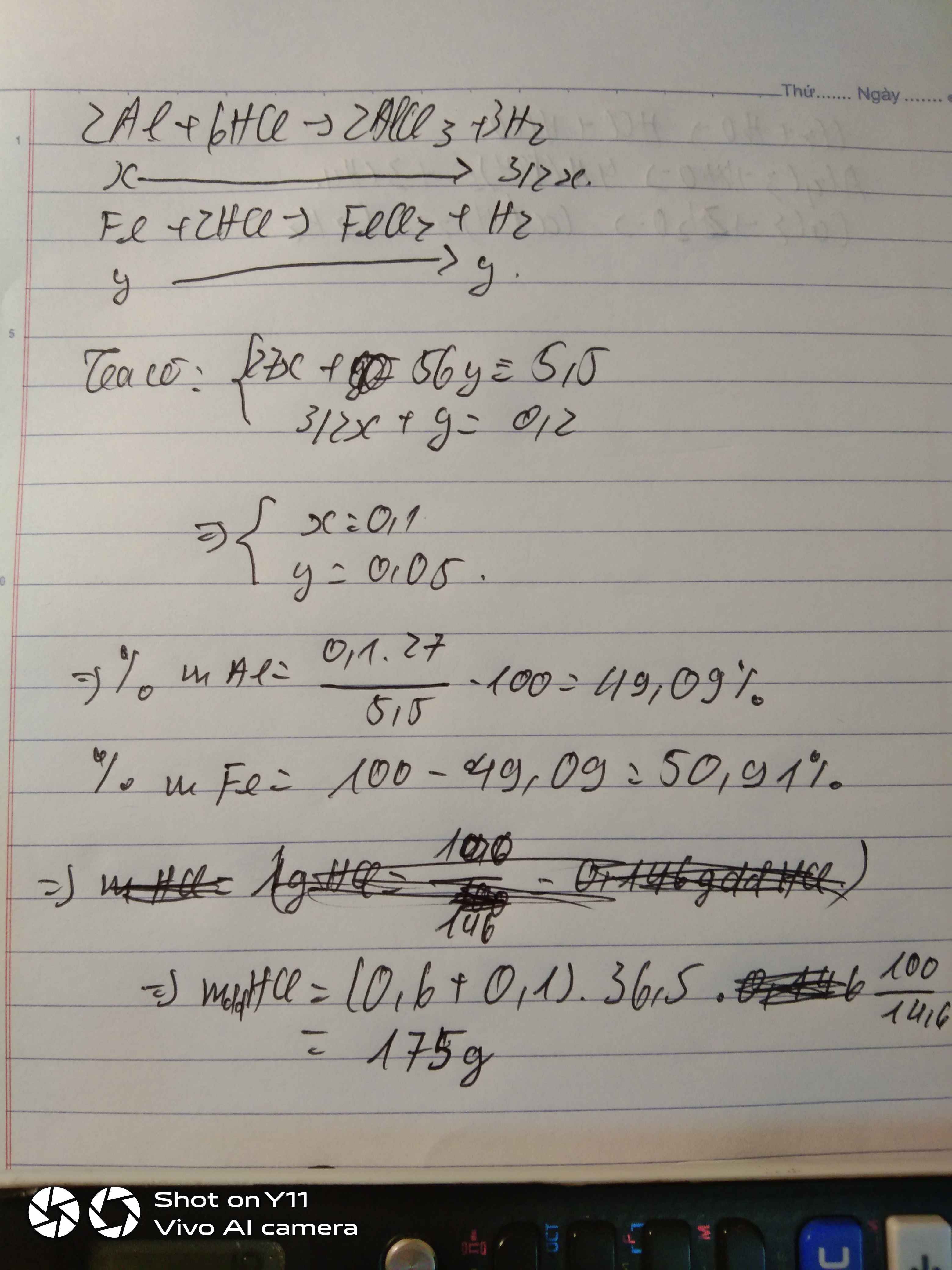



a)
\(n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{Mg} = a\ mol; n_{Fe} = b\ mol\\ Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2 \)
Theo PTHH, ta có:
\(\left\{{}\begin{matrix}24a+56b=5,2\\a+b=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
Suy ra:
\(\%m_{Mg} = \dfrac{0,1.24}{5,2}.100\% = 46,15\%\\ \%m_{Fe} = 100\% - 46,15\% = 53,85\% \)
b)
\(n_{HCl} = 2n_{H_2} = 0,15.2 = 0,3(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,3}{1} = 0,3(lít) \)
Đặt :
nMg = a mol
nFe= b mol
mhh = 24a + 56b = 5.2 (g) (1)
Mg + 2HCl => MgCl2 + H2
Fe + 2HCl => FeCl2 + H2
nH2 = a + b = 0.15 (2)
(1) , (2)
a = 0.1
b = 0.05
%Mg = 2.4/5.2 * 100% = 46.15%
%Fe = 100 - 46.15 = 53.85%
nHCl = 2a + 2b = 0.05 * 2 + 0.1*2 = 0.3 (mol)
VddHCl = 0.3/1=0.3 (l)