Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`a)`
`Fe + H_2 SO_[4(l)] -> FeSO_4 + H_2↑`
`0,02` `0,02` `(mol)`
`n_[Fe] = [ 1,12 ] / 56 = 0,02 (mol)`
`=> V_[H_2] = 0,02 . 22,4 = 0,448 (l)`
_______________________________________________
`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2 (SO_4)_3 + 6H_2 O + 3SO_2↑`
`0,02` `0,03` `(mol)`
`=> V_[SO_2] = 0,03 . 22,4 = 0,672 (l)`
a)
\(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,02 0,02
\(V_{H_2}=0,02.22,4=0,448\left(l\right)\)
b) \(PTHH:2Fe+6H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,02 0,03
=> \(V_{SO_2}=0,03.22,4=0,672\left(l\right)\)

a)
n O = 6,13.23,491%/16 = 0,09(mol)
=> n Al2O3 = 1/3 n O = 0,03(mol)
n H2 = 1,456/22,4 = 0,065(mol)
$H_2O \to OH^- + \dfrac{1}{2}H_2$
Suy ra: n OH = 2n H2 = 0,065.2 = 0,13(mol)
Al2O3 + 2OH- → 2AlO2- + H2O
0,03......0,06..........0,06.....................(mol)
DUng dịch G có :
AlO2- : 0,06
OH- : 0,13 - 0,06 = 0,07(mol)
Áp dụng CT :
n H+ = 4n AlO2- + n OH- - 3n Al(OH)3
<=> 0,16 = 0,06.4 + 0,07 - 3n Al(OH)3
<=> n Al(OH)3 = 0,05(mol)
<=> m = 0,05.78 = 3,9(gam)
Trong F :
m Na + m K + m Ba = m D - m Al2O3 = 6,13 - 0,03.102 = 3,07(gam)
n Cl = n HCl = 0,16(mol)
n Al3+ = 0,06 - 0,05 = 0,01(mol)
=> m chất tan = 3,07 + 0,16.35,5 + 0,01.27 = 9,02(gam)

1. Ta có: m dd A = mFe2O3 (pư) + m dd H2SO4
⇒ mFe2O3 (pư) = 474 - m (g) \(\Rightarrow n_{Fe_2O_3\left(pư\right)}=\dfrac{474-m}{160}\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{m.9,8\%}{98}\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Theo PT: \(n_{H_2SO_4}=3n_{Fe_2O_3}\)
\(\Rightarrow\dfrac{9,8\%m}{98}=3.\dfrac{474-m}{160}\) \(\Rightarrow m=450\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=0,45\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,45}{3}\), ta được Fe2O3 dư.
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15.400}{474}.100\%\approx12,66\%\)
2. Sau khi cho 48 (g) Fe2O3 vào 450 (g) dd H2SO4 thu được thì trong bình chứa dd A: 0,15 (mol) Fe2(SO4)3 và 0,15 (mol) Fe2O3 dư.
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,15________0,15_______________0,3________0,3 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,1___________0,3________0,1 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,1___________0,1______________0,2_________0,2 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,05_________0,15________0,05 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
_0,05________0,05______________0,1_______0,1 (mol)
⇒ nSO2 = 0,15 + 0,1 + 0,05 = 0,3 (mol)
⇒ m dd B = 48 + 450 + 0,3.64 = 517,2 (g)
Dd B gồm: FeSO4: 0,6 (mol) và H2SO4: 0,15 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,6.152}{517,2}.100\%\approx17,63\%\\C\%_{H_2SO_4}=\dfrac{0,15.98}{517,2}.100\%\approx2,84\%\end{matrix}\right.\)
Mình bổ sung cách làm ngắn hơn cho phần 2 nhé.
2. SO2 dư → dd B có FeSO4 và H2SO4
BTNT Fe, có: nFeSO4 = 2nFe2O3 = 0,6 (mol)
BT e, có: 2nSO2 = nFeSO4 ⇒ nSO2 = 0,3 (mol)
NTNT S, có: nSO2 + nH2SO4 (ban đầu) = nFeSO4 + nH2SO4
⇒ nH2SO4 = 0,3 + 0,45 - 0,6 = 0,15 (mol)
→ B gồm: FeSO4: 0,6 (mol) và H2SO4: 0,15 (mol)
Có: m dd B = 48 + 450 + 0,3.64 = 517,2 (g)
⇒ C%

\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\\ 2Al+ 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O\\ b) n_{Fe} = a(mol) ; n_{Al} = b(mol) \Rightarrow 56a + 27b = 11(1)\\ n_{SO_2} = 1,5a + 1,5b = \dfrac{10,08}{22,4} = 0,45(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,2\\ \%m_{Fe} = \dfrac{0,1.56}{11}.100\% = 50,91\%\\ \%m_{Al} = 100\%-50,91\% = 49,09\%\)

a) Gọi số mol Al, Zn là a, b (mol)
=> 27a + 65b = 11,9 (1)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a----------------->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b------>b------------------>b
=> 1,5a + b = 0,4 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11,9}.100\%=45,378\%\\\%m_{Zn}=\dfrac{0,1.65}{11,9}.100\%=54,622\%\end{matrix}\right.\)
b) nH2SO4 = 1,5a + b = 0,4 (mol)
=> mH2SO4 = 0,4.98 = 39,2 (g)
=> \(C\%_{dd.H_2SO_4}=\dfrac{39,2}{150}.100\%=26,133\%\)

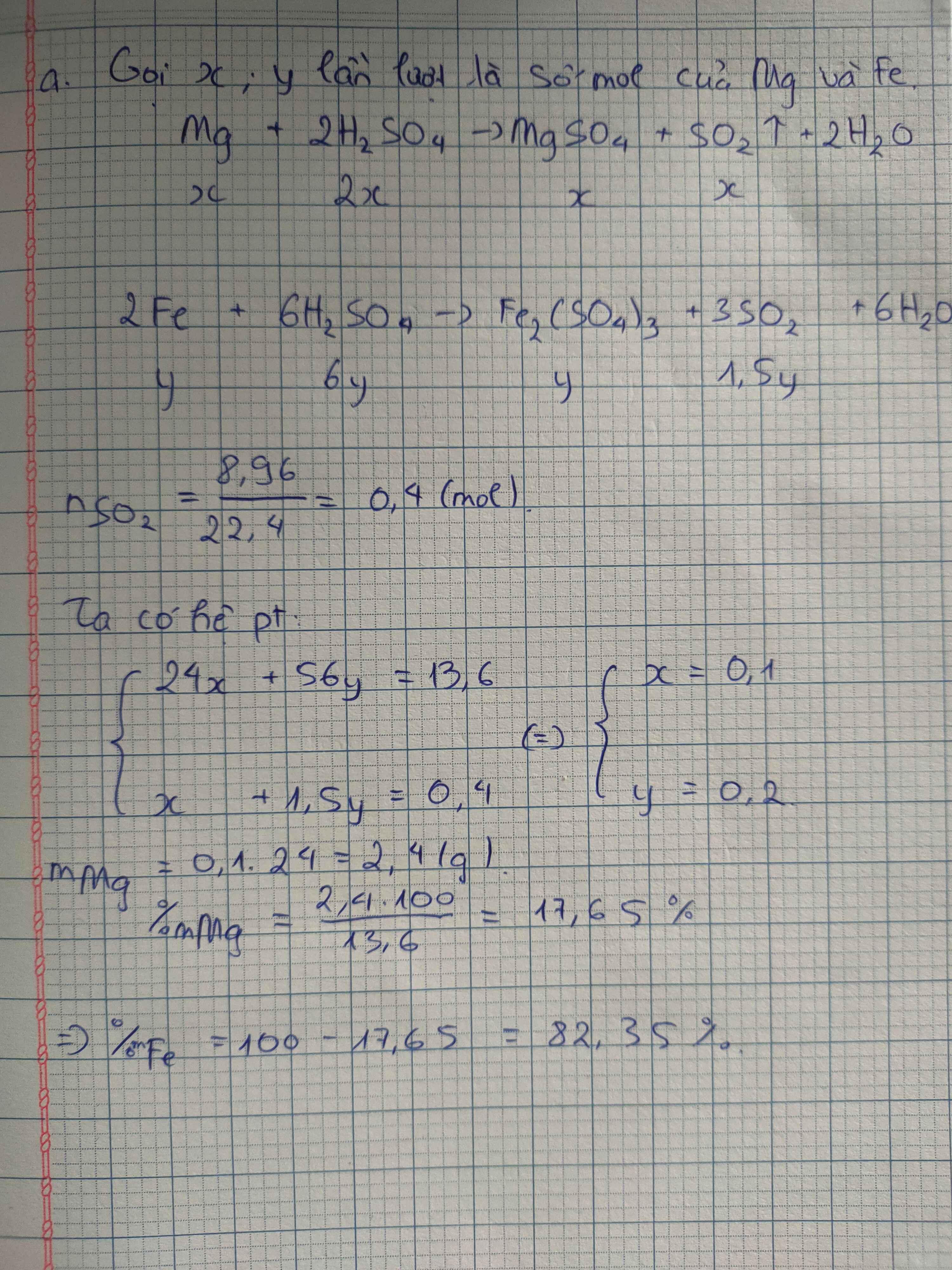


PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\:\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)
Cũng là bài đó mà câu b, cho dd B tác dụng dd KMnO4 2M đến khi dd mất màu tím thì thấy có V2 ml dd KMnO4 tham gia pứ . Tính giá trị của V2?