Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (1)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\) (2)
b) Dựa vào đề, ta thấy chắc chắn HCl dư
Ta có: \(\Sigma n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Mg là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}56a+24b=8\\a+b=0,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=56\cdot0,1=5,6\left(g\right)\\m_{Mg}=24\cdot0,1=2,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{8}\cdot100\%=70\%\\\%m_{Mg}=30\%\end{matrix}\right.\)
c) Theo các PTHH: \(n_{FeCl_2}=n_{MgCl_2}=n_{Fe}=n_{Mg}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\m_{MgCl_2}=0,1\cdot95=9,5\left(g\right)\end{matrix}\right.\) \(\Rightarrow m_{muối}=22,2\left(g\right)\)
d) Ta có: \(\Sigma n_{HCl}=\dfrac{500\cdot16\%}{36,5}=\dfrac{160}{73}\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=\dfrac{654}{365}\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=\dfrac{654}{365}\cdot36,5=65,4\left(g\right)\)
Mặt khác: \(m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=507,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{12,7}{507,6}\cdot100\%\approx2,5\%\\C\%_{MgCl_2}=\dfrac{9,5}{507,6}\cdot100\%\approx1,87\%\\C\%_{HCl\left(dư\right)}=\dfrac{65,4}{507,6}\cdot100\%\approx12,88\%\end{matrix}\right.\)

Đề chưa nói rõ là : tác dụng với dung dịch axit nào nên có lẽ là HCl hoặc H2SO4 , thứ hai là câu c không đủ dữ kiện đề bài để giải nhé.
\(Đặt:n_{Mg}=x\left(mol\right),n_{Fe}=y\left(mol\right)\)
\(m_{hh}=24x+56y=8\left(g\right)\left(1\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=x+y=0.2\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.1\)
\(\%Mg=\dfrac{0.1\cdot24}{8}\cdot100\%=30\%\\ \%Fe=70\%\)
\(m_M=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.1\cdot127=22.2\left(g\right)\)

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\\ a,\%m_{Fe}=\dfrac{0,02.56}{4,36}.100\approx25,688\%\\ \Rightarrow\%m_{Ag}\approx74,312\%\\ b,Ta.thấy:2,18=\dfrac{1}{2}.4,36\\ \Rightarrow m_{hh\left(câuB\right)}=\dfrac{1}{2}.m_{hh\left(câuA\right)}\\ n_{Fe}=\dfrac{0,02}{2}=0,01\left(mol\right)\\ n_{Ag}=\dfrac{2,18-0,01.56}{108}=0,015\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ 2Ag+Cl_2\rightarrow\left(t^o\right)2AgCl\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+\dfrac{1}{2}.n_{Ag}=\dfrac{3}{2}.0,01+\dfrac{1}{2}.0,015=0,0225\left(mol\right)\\ \Rightarrow V_{Cl_2\left(đktc\right)}=0,0225.22,4=0,504\left(l\right)\)
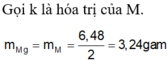

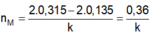
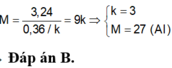



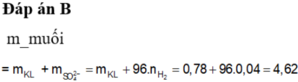
Đặt nMg = x, nCa = y
=> 24x + 40y = 6,4 (1)
Pt:
Mg + H2SO4 => MgSO4 + H2
x => x x
Ca + H2SO4 => CaSO4 + H2
y => y y
=> x + y = \(\dfrac{4,48}{22,4}=0,2\) (2)
Từ 1 và 2 => x = 0,x và y = 0,1
=> mMg = 0,1.24 = 2,4
mCa = 6,4 - 2,4 = 4g
m muối = mMgSO4 + mCaSO4 = 0,1.120 + 0,1.136 = 25,6g
a, PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Ca+H_2SO_4\rightarrow CaSO_4+H_2\)
Bảo toàn e: \(n_{Mg}+n_{Ca}=n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Lại có: \(24n_{Mg}+40n_{Ca}=6,4\)
\(\Rightarrow n_{Mg}=n_{Ca}=0,1\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right);n_{Ca}=0,1.40=4\left(g\right)\)
b, Tính kim loại muối??