Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Mg} = n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có :
$24a + 27a + 56b = 15,8(1)$
$n_{HCl} > 2n_{H_2}$ nên HCl dư
Ta có :
$n_{H_2} = a + 1,5a + b = \dfrac{13,44}{22,4} = 0,6(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{Al} = \dfrac{0,2.27}{15,8}.100\% = 34,18\%$
$\%m_{Mg} = \dfrac{0,2.24}{15,8}.100\% = 30,38\%$
$\%m_{Fe} = 35,44\%$
$n_{HCl\ pư} = 2n_{H_2} = 1,2(mol)$
Bảo toàn khối lượng : $m_{muối} = 15,8 + 1,2.36,5 - 0,6.2 = 58,4(gam)$

Mg +H2SO4--->MgSO4 +H2
x x x x mol
Fe+ H2SO4---> FeSO4+ H2
y y y y mol
theo bài ta có : 24x+ 56y=1,36 và x+y=0,672/22,4
=> x=0,01 mol và y=0,02 mol
=> mMg=0,24 gam mFe=1,12 gam
tớ thấy đề bài khó để là ý b) bạn ạ nếu bạn xem lạ đề bài thì tốt quá![]()

a, Ta có: 24nMg + 56nFe = 12,8 (1)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,3\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,8}{2}=0,4\left(l\right)\)
c, \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Theo PT: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,3.58+0,1.90=26,4\left(g\right)\)
a. Số gam mỗi kim loại trong hỗn hợp ban đầu:
Mg: 9,6 gamFe: 22,4 gamb. Thể tích dung dịch HCl 2M đã phản ứng: 0,2 lít
c. Khối lượng kết tủa thu được khi dd A tác dụng với dung dịch NaOH dư là 0,4 gam.
------------------------------------đấy

Câu 1
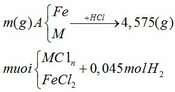
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
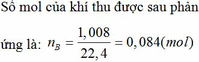
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
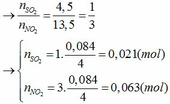
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
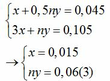
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.



a, nH2 = 0,6 (mol)
nHCl = 1,25 (mol)
Thấy : nHCl > 2nH2 => HCl dư
Gọi x là số mol của Mg , Al ( do nMg = nAl ) , y là số mol của Fe
PT : Mg + 2HCl → MgCl2 + H2↑
Mol : x------> 2x----------------->x
2Al + 6HCl → 2AlCl3 + 3H2↑
Mol : x --->3x------------------> 3/2x
Fe + 2HCl → FeCl2 + H2↑
Mol : y------>2y----------------> y
Ta có : 51x+ 56y = 15,8 và 5/2x + y = 0,6
=> x= 0,2 , y=0,1
=> %mMg = \(\frac{24.0,2}{15,8}.100\%\)= 30,38 %
%mAl = \(\frac{27.0,2}{15,8}.100\%\) = 34,18%
=> %mFe = 100 - 30,38 - 34,18 = 35,44%
b, mHCl pu = (0,6 + 0,4 + 0,2 ) .36,5 = 43,8 (g)
ĐLBTKL : mmuối = 15,8 + 43,8 - (0,6.2) = 58,4 (g)
c, Dung dịch A gồm 0,2mol AlCl3 , 0,2 mol MgCl2 , 0,1 mol FeCl2 và 0,05 mol HCl dư
CMHCl = \(\frac{0,05}{0,5}\)= 0,1M
CMFeCl2 = \(\frac{0,1}{0,5}\)= 0,2M
CMAlCl3 = CMMgCl2 = \(\frac{0,2}{0,5}\) = 0,4M