Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Những tính chất khác biệt:
+ Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chât có tính khử.
+ H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe +H2SO4 (loãng) → FeSO4 + H2
Cu +H2SO4 (loãng) : không có phản ứng
- Những tính chất chung:
+ Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Thí dụ:
Đổi màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)2 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(HNO3)3+ 3H2O
HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2
+ Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Thí dụ:
Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O
Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2 + 2SO2 + 2H2O
S+ 2HNO3 → H2SO4 +2NO
Tác dụng với hợp chất( có tính khử)
3FeO +10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2Fe(OH)2 + 4H2SO4(đặc) → Fe2(SO4)3 + SO2 + H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)

- Những tính chất khác biệt:
+ Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3 dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chất có tính khử.
+ H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe + H2SO4 (loãng) → FeSO4 + H2↑
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
- Những tính chất chung:
∗ Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Thí dụ:
Đổi màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2↑
∗ Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Thí dụ:
Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2↑ + 2H2O
Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2↑ + 2SO2↑ + 2H2O
S + 2HNO3 → H2SO4 + 2NO↑
Tác dụng với hợp chất( có tính khử)
3FeO + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
2FeO + 4H2SO4(đặc) → Fe2(SO4)3 + SO2↑ + 4H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)

Tính chất giống nhau
- Đều có tính oxi hoá
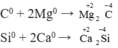
- Đều có tính khử
Tác dụng với phi kim
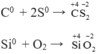
Tác dụng với hợp chất:
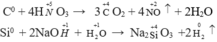

- Những tính chất chung: Đều có tính axit
+ Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
- Những tính chất khác nhau:
| HNO3 | H3PO4 |
| - Axit HNO3 là axit mạnh HNO3 → H+ + NO3- - Axit HNO3 có tính oxi hoá mạnh Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O S + 2HNO3 → H2SO4 + 2NO 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O |
- Axit H3PO4 là một triaxit trung bình H3PO4 ⇆ H+ + H2PO4- H2PO4- ⇆ H+ + HPO42- HPO42- ⇆ H+ + PO43- - Axit H3PO4 không có tính oxi hoá. 3Fe + 2H3PO4 → Fe3(PO4)2 + 3H2 S + H3PO4 → không phản ứng 3FeO +2H3PO4 → Fe3(PO4)2 + 3H2O |

Sơ đồ: SiO2 → Na2SiO3 → H2SiO3
Phương trình phản ứng:
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + 2HCl → 2NaCl + H2SiO3 ↓

Dãy chuyển hóa có thể là:
![]()
Các phương trình hóa học có thể là:
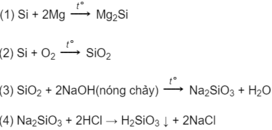

Phương trình hoá học ở dạng phân tử và dạng ion rút gọn của các phản ứng xảy ra trong dung dịch :
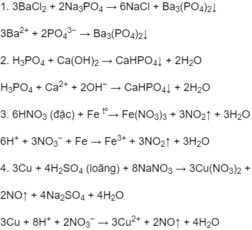

Lấy mỗi chất một ít ra các ống nghiệm tương ứng có đánh số từ 1 đến 4:
1- Cho quỳ tím vào 4 lọ mẫu thử đã đánh số => Lọ chứa Axit etanoic sẽ đổi màu quỳ tím thành đỏ
2- Tiếp tục cho 3 lọ còn lại phản ứng hóa học với Dd AgNO3/NH3, có xúc tác t0 => Lọ chứa Propanal sẽ có kết tủa màu trắng
CH3-CH2CHO + 2AgNO3 + 3NH3 + H2O → CH3-CH2COONH4 + 2Ag↓ + 2NH4NO3
3- Cho vào 2 lọ còn lại vài giọt Dd Br2 => Lọ chứa Stiren sẽ làm mất màu Dd Br2
C6H5CH=CH2 + Br2 →C6H5CHBr -CH2Br
4- Lọ còn lại là Etanol
Lấy mẫu thử: Lấy mỗi chất một ít ra các ống nghiệm tương ứng có đánh số từ 1 đến 4 :
| Axit etanoic | Etanol | Propanal | Stiren | |
| Quỳ tím | Đỏ | \(-\) | \(-\) | \(-\) |
| Dd AgNO3/NH3,to | \(\times\) | \(-\) | \(\downarrow\)Trắng | \(-\) |
| Dd Br2 | \(\times\) | \(-\) còn lại | \(\times\) | mất màu dd Br2 |
PTHH:
CH3\(-\)CH2CHO + 2AgNO3 + 3NH3 + H2O \(\underrightarrow{t}\) CH3\(-\)CH2COONH4 + 2Ag + 2NH4NO3
C6H5CH\(=\)CH2 + Br2 \(\rightarrow\) C6H5CHBr\(-\)CH2Br


Axit nitric và axit sunfuric đặc đều có tính oxi hóa mạnh.
Ví dụ: 3FeO +10HNO3 —> 3Fe(NO3)3 + NO ↓+ 5H2O
2FeO + 4H2SO4 —> Fe2SO4)3 + SO2 + 4H2O
Tuy nhiên nếu như HNO3 loãng vẫn có tính oxi hóa thì H2SO4 loãng lại không có tính oxi hóa. Ví dụ
3Fe3O4 + 28HNO3 l -> 9Fe(NO3)3 + NO↓+ 14H2O Fe3O4 + 4H2SO4 l —> FeSO4 + Fe2(S04)3 + 4H2O