Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong các đơn chất halogen, chất điều kiện thường ở trạng thái rắn là I 2 .
Chọn đáp án D.

Trong các đơn chất halogen, chất ở trạng thái lỏng là B r 2 .
Chọn đáp án C.

- Trong tự nhiên, các halogen tồn tại ở dạng hợp chất
- Điều chế:
+ F2: Điện phân hỗn hợp KF, HF
+ Cl2:
* Cho HCl đặc tác dụng với chất oxh mạnh như MnO2, KMnO4,..
* Điện phân dung dịch NaCl
+ Br2: Dùng Cl2 để oxh NaBr thành Br2
+ I2: Điều chế từ rong biển

- Để so sánh được xu hướng biến đổi một số tính chất của các nguyên tố, ta cần nắm được: Theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Độ âm điện: tăng dần trong một chu kì, giảm dần trong một nhóm A.
+ Tính kim loại: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Tính phi kim: tăng dần trong một chu kì, giảm dần trong một nhóm A.
- Giải thích:
+ Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng do lực hút giảm.
+ Độ âm điện phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
+ Tính kim loại và phi kim phụ thuộc vào bán kính và lực hút giữa hạt nhân với các electron lớp ngoài cùng.

Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 electron, tính oxi hóa của các halogen giảm dần từ flo đến iot. Sở dĩ tính oxi hóa giảm dần từ flo đến iot là do:
- Độ âm điện giảm dần từ flo đến iot.
- Từ flo qua clo đến brom và iot, lớp electron ngoài cùng càng xa hạt nhân hơn, bán kính nguyên tử tăng dần, lực hút của hạt nhân với electron ngoài cùng càng yếu hớn, làm cho khả năng nhận electron của halogen giảm dần.

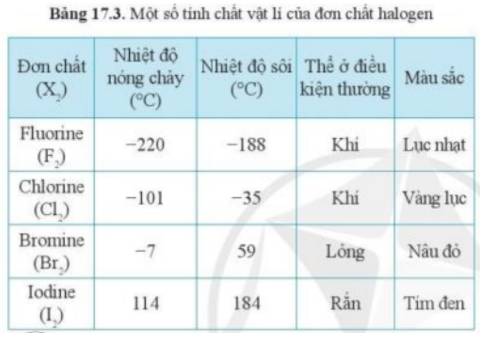


- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals