Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có PTHH:
\(2Cu+O_2\rightarrow2CuO\)
Ta có số mol của các chất :
\(n_{Cu}=\frac{m_{Cu}}{M_{Cu}}=\frac{12,8}{64}=0,2\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow\frac{n_{Cu}}{2}=\frac{0,2}{2}< \frac{0,5}{1}=\frac{n_{O_2}}{1}\)
\(\Rightarrow\)Cu hết, O2 dư
\(\Rightarrow\)Tính theo Cu
Ta viết lại PTHH theo tỉ số các chất ;
\(2Cu+O_2\rightarrow2CuO\)
Ban đầu: \(0,2\) \(0,5\) \(0\)
Phản ứng: \(0,2\) \(0,1\) \(0,2\)
Sau phản ứng: \(0\) \(0,4\) \(0,2\)
\(\Rightarrow\)Khối lượng chất tạo thành là :
\(m_{CuO}=n_{CuO}.M_{CuO}=0,2.80=16\left(g\right)\)

\(n_P=\dfrac{m_P}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,4 < 0,53125 ( mol )
0,4 0,5 0,2 ( mol )
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là P2O5
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,2.142=18,4g\)

nP = 24.8 / 31 = 0.8 (mol)
nO2 = 34 / 32 = 1.0625 (mol)
4P + 5O2 -to-> 2P2O5
Bđ: 0.8.....1.0625
Pư: 0.8.........1...............0.4
KT : 0..........0.0625.........0.4
mO2 (dư) = 0.0625 * 32 = 2 (g)
mP2O5 = 0.4 * 142 = 56.8 (g)
PTHH: 4P + 5O2 -\(t^0\) --> 2P2O5
ta có n=m/M
=> nP =0,8 và nO2=2,125
theo pt có
nP/4=0,2 < nO2/5=0,425
=> Oxi dư
theo pt
\(\dfrac{nO2\left(pư\right)}{nP}=\dfrac{5}{4}\Rightarrow nO2\left(pư\right)=\dfrac{5}{4}\cdot0,8=1mol\)
nO2(dư)= 2,125-1=1,125mol
b, chất đc tạo thành là: đi photpho penta oxit
theo pt
\(\dfrac{nP2O5}{nP}=\dfrac{2}{4}\Rightarrow nP2O5=\dfrac{2}{4}\cdot0,8=0,4mol\)
ADCT: m=nM
=> mP2O5=0,4*142=56,8g

\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(n_{O_2}=\dfrac{16}{32}=0,5mol\)
\(S+O_2\underrightarrow{t^o}SO_2\)
0,2 0,5 0,2
Sau phản ứng oxi còn dư và dư \(0,5-0,2=0,3mol\)
Oxit axit được tạo thành là \(SO_2\) và có khối lượng:
\(m_{SO_2}=0,2\cdot64=12,8g\)

a) Số mol photpho và khí oxi lần lượt là 12,4:31=0,4 (mol) và 19,2:32=0,6 (mol).
4P (0,4 mol) + 5O2 (0,5 mol) \(\underrightarrow{t^o}\) 2P2O5 (0,2 mol).
Do 0,4:4<0,6:5 nên khí oxi dư 0,6-0,5=0,1 (mol).
b) Điphotpho pentaoxit (P2O5) được tạo thành có khối lượng 0,2.142=28,4 (g).

\(n_P=\dfrac{m_p}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,4 0,53125 ( mol )
ta có: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\)
=> Chất dư là \(O_2\)
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là \(P_2O_5\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=\left(\dfrac{0,4.2}{4}\right).142=28,4g\)

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{17}{32} = 0,53125(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)$
$\Rightarrow n_{O_2\ dư} = 0,53125 - 0,5 = 0,03125(mol)$
b) Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ Vì:\dfrac{0,4}{4}< \dfrac{0,53125}{5}\Rightarrow O_2dư\\ n_{O_2\left(dư\right)}=\dfrac{5}{4}.0,4=0,5\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=32.\left(0,53125-0,5\right)=1\left(g\right)\\ n_{P_2O_5}=\dfrac{2}{4}.0,4=0,2\left(mol\right)\\ \Rightarrow m_{P_2O_5}=142.0,2=28,4\left(g\right)\)

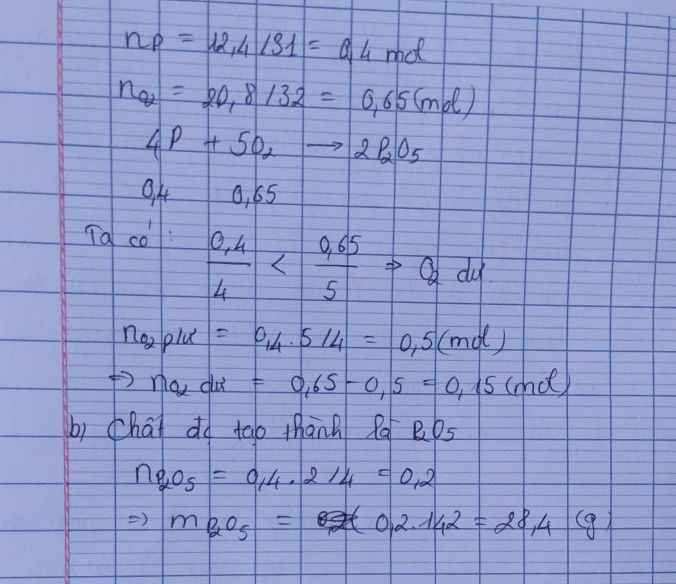
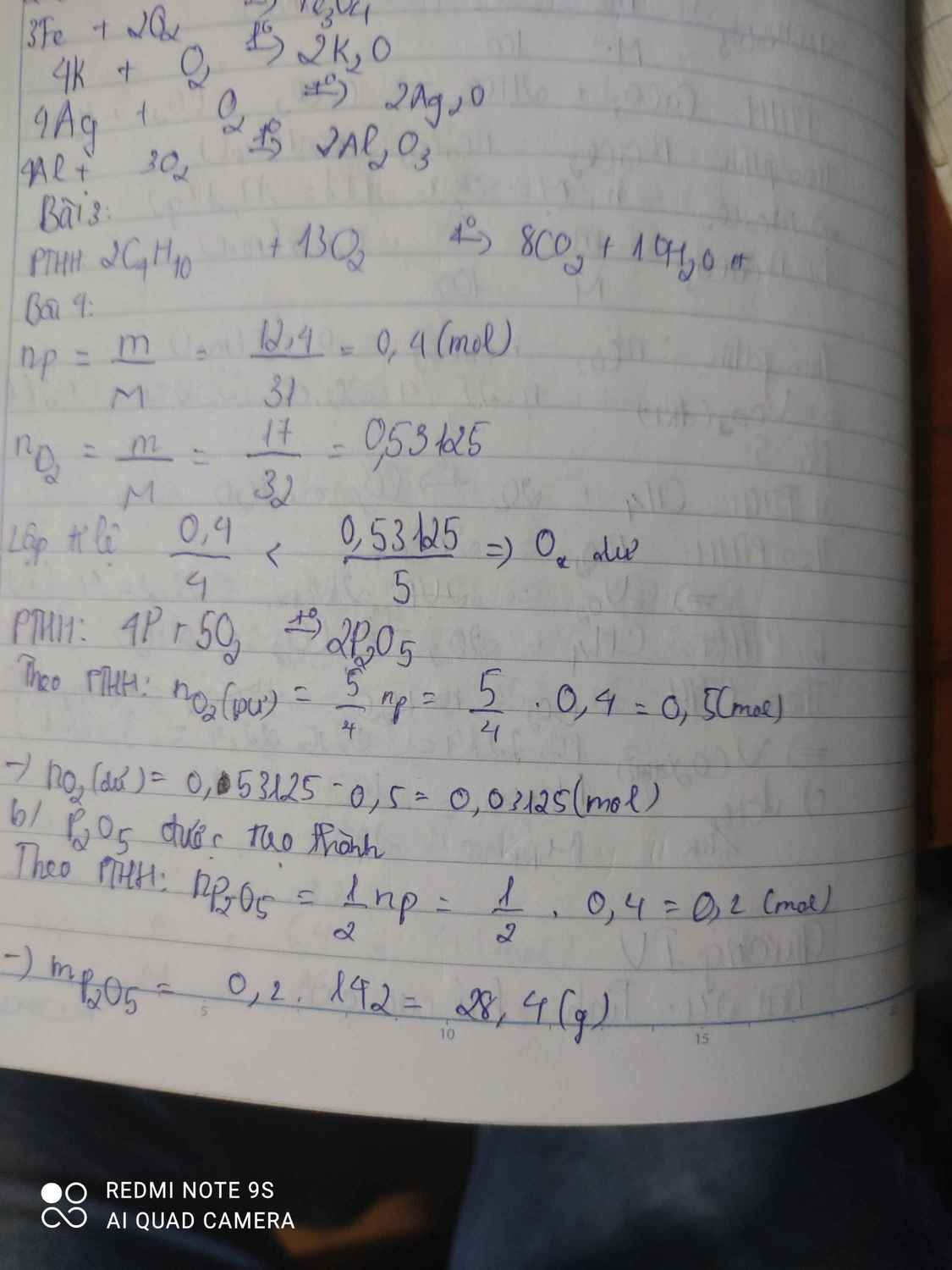

nCu = 12.8/64 = 0.2 mol
nO2 = 11.2/22.4 = 0.5 (mol)
Cu + 1/2O2 -to-> CuO
0.2____0.1______0.2
m O2 dư = ( 0.5 - 0.1 ) * 32 = 12.8 (g)
mCuO = 0.2*80=16 (g)