Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
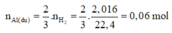
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
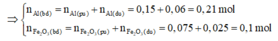
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

PTHH: Fe + 2HCl → FeCl2 + H2 ↑
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Gọi số mol của Fe là a, số mol của Al là 2b => Số mol của H2 ở pt (1) là a , số mol H2 ở pt (2) là 3b
Số mol của khí H2 sinh ra là: 11,2 : 22,4 = 0,5 mol
a) Ta có hệ phương trình:
- 56a + 54b = 16,6
- a + 3b = 0,5
=> a = 0,2 , b = 0,1
Khối lượng của sắt là: 56a = 56. 0,2 = 11,2 (gam)
%Fe là: (11,2 : 16,6).100% = 67,47%
Khối lượng của nhôm là: 54b = 54. 0,1 = 5,4 (gam)
%Al là: (5,4 : 16,6).100% = 32,53%
b) Khối lượng của HCl là: 2a+6b = 1 (mol)
Khối lượng của HCl là: 1 . 36,5 = 36,5 (gam)
Khối lượng dung dịch HCl là: 36,5 : 14,6% = 250 (g)
c) Khối lượng FeCl2 là: 127 . 0,2 = 25,4 (gam)
Khối lượng AlCl3 là: 133,5 . 2 . 0,1 = 26,7 (gam)
Sau đó áp dụng định luật bảo toàn khối lượng:
Khối lượng dung dịch muối thu được là:
16,6 + 250 - ( 0,5 . 2) = 265,6(gam)
Nồng độ phần trăm FeCl2 trong dung dịch muối là:
(25,4 : 265,6) . 100% = 9,564%
Nồng độ phần trăm AlCl3 trong dung dịch muối là:
( 26,7 : 265,6 ) . 100% = 10,06%
gọi x,y là số mol của Fe và Al trong hỗn hợp
nH2=0,4mol
PTHH: 2Al+6HCl=>2AlCl3+3H2
y---------------------->1,5y
Fe+2HCl=> FeCl2+H2
x-------------------->x
ta có hệ :\(\begin{cases}56x+27y=16,6\\x+1,5y=0,5\end{cases}\)<=> x=0,2 và y=0,2
=> mFe=0,2.56=11,2g
=> %mFe=67,47%
=> %mAl=32,53%
m(HCl)=(0,2+0,2).36,5=14,6g
=> khối lượng dung dịch đã dùng là : 146g

\(a)n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\\ n_{Fe}=a;n_{Al}=b\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow\left\{{}\begin{matrix}56a+27b=11\\a+1,5b=0,4\end{matrix}\right.\\ \Rightarrow a=0,1;b=0,2\)
\(\%m_{Fe}=\dfrac{0,1.56}{11}\cdot100=50,91\%\\ \%m_{Al}=100-50,91=49,09\%\)
\(b)Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(2Al+6HCl\rightarrow2AlCl_2+3H_2\)
0,2 0,6 0,2 0,3
\(m_{HCl}=\dfrac{\left(0,2+0,6\right).36,5}{9,125}\cdot100=320g\)
\(c)m_{dd}=320+11-0,1.2-0,3.2=308,2g\)
\(C_{\%FeCl_2}=\dfrac{0,1.127}{308,2}\cdot100=4,12\%\\ C_{\%AlCl_3}=\dfrac{0,2.133,5}{308,2}\cdot100=8,66\%\)

$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}56x+27y=2,78\\x+1,5y=0,07\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,02\end{matrix}\right.\\ n_{FeCl_2}=n_{Fe}=0,04\left(mol\right)\\ \Rightarrow m_{FeCl_2}=0,04.127=5,08\left(g\right)\)


8Al + 3 F e 3 O 4 → 4 A l 2 O 3 + 9Fe (1)
TH1: Al dư, vậy hỗn hợp sau phản ứng là: A l 2 O 3 , Fe, Al dư.
Gọi x và y lần lượt là số mol Al phản ứng và số mol Al dư.
2Al + 6HCl → 2AlCl3 +3 H 2 (2)
Fe + HCl → FeCl2 + H 2 (3)
Theo PTHH (1), ta có:
nFe3O4 = 3/8 . x, nFe = 9/8 . x
Theo PTHH (2) và (3), ta có:
n H 2 (2) = 3/2 . y
n H 2 (3) = 9/8 . x
Từ trên ta có hệ pt:
3 8 x . 232 + X . 27 + Y . 27 9 8 x + 3 2 y + n H 2 ⇔ 114 x + 27 y = 9 , 66 9 8 x + 3 2 y = 2 , 688 22 , 4 = 0 , 12 ⇔ x = 0 , 08 m o l y = 0 , 02 m o l
⇒ nAl(bđ) = nAl(pư) + nAl(dư)
= x+y = 0,08+0,02=0,1 mol
⇒ mAl(bđ) = 0,1.27 = 2,7g
TH2: Fe3O4 dư, suy ra hỗn hợp sau phản ứng: A l 2 O 3 , Fe, F e 3 O 4 dư.
Gọi a, b là số mol Al phản ứng và số mol F e 3 O 4 dư.
Theo PTHH (1) ta có:
n F e 3 O 4 (pư) = 3/8 . a, nFe(sp) = 9/8 . a
Fe + 2HCl → F e C l 2 + H 2 (4)
Theo PTHH (4), ta có:
nFe(sp) = nH2 = 9a/8 = 2,688/22,4 = 0,12 mol
⇒ a = 8/75 mol
m b d = m A l + m F e 3 O 4 p u + m F e 3 o 4 d u ⇔ 9 , 66 = 8 75 . 27 + 3 8 . 232 . 8 75 + b . 232
⇒ b = 0,01(loại)
Vậy khối lượng Al ban đầu là 2,7 gam
⇒ Chọn B.