Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2A+Cl2->2ACl
nA=nACl
mA/mACl=MA/MA+35.5
Theo bài ra:mA:mACl=9.2:23.4
->MA/MA+35.5=9.2/23.4
->MA=23(g/mol)->A là Natri
theo đề bài, khí là Cl2
gọi Kim loại đó là A
PTK của nó là MA
số mol của nó là a
PT: 2A+CL2=>2ACl
nACl=nA=a
theo bài ra ta có :
MA*a=9,2
(MA+35,5)*a=23,4
giải hệ này ra sẽ tính được a=0,4
từ đó tính được PTK của kim loại = 23 => đó là Na

2M+nCl2\(\rightarrow\)2MCln
mCl2=23,4-9,2=14,2(g)
nCl2=\(\frac{14,2}{71}\)=0,2(mol)
\(\rightarrow\)nM=\(\frac{0,4}{n}\)
MM=\(\frac{9,2}{\frac{0,4}{n}}\)=23n
n=1 MM=23
\(\rightarrow\) M là Natri
Vậy CTHH của muối là NaCl

- Gọi kí hiệu và nguyên tử khối của kim loại là M.
Phương trình hoá học :
2M + Cl 2 → 2MCl
9,2 x 2(M + 35,5) = 2M x 23,4
653,2 = 28,4M
M = 23. Vậy kim loại M là kim loại natri (Na).

Giả sử kim loại A có hóa trị n.
PTHH : 2A + nCl2 --> 2ACln
Áp dụng ĐLBT khối lượng => mCl2 = 23,4-9,2 =14,2 gam <=> nCl2=\(\dfrac{14,2}{71}\)= 0,2 mol
=> nA = 0,4/n => MA = \(\dfrac{9,2.n}{0,4}\)= 23n
=> giá trị thỏa mãn là n = 1 , MA = 23 ( g/mol ) , A là natri (Na)

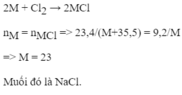
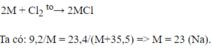

Đặt M là KHHH của kim loại hoá trị I.
PTHH: 2M + Cl2 → 2MCl
2M(g) (2M + 71)g
9,2g 23,4g
Ta có: 23,4 x 2M = 9,2(2M + 71)
Suy ra: M = 23.
Kim loại có khối lượng nguyên tử bằng 23 là Na.
Vậy muối thu được là: NaCl