Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Zn + 2HCl → ZnCl2 + H2
b) nZn = 2 mol = nZnCl2 = nH2
=> mZnCl2 = 2 .136 = 272 gam
c) nH2 = 2.22,4 = 44,8 lít

\(n_{Al}=\dfrac{10.8}{27}=0.4\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.4........1.2.........0.4..........0.6\)
\(m_{HCl}=1.2\cdot36.5=43.8\left(g\right)\)
\(m_{AlCl_3}=0.4\cdot133.5=53.4\left(g\right)\)
\(m_{dd}=10.8+100-0.6\cdot2=109.6\left(g\right)\)
\(C\%_{AlCl_3}=\dfrac{53.4}{109.6}\cdot100\%=48.72\%\)

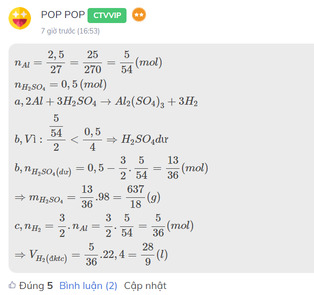
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)

a) $n_{Al} = \dfrac{0,81}{27} = 0,03(mol) ; n_{HCl} = \dfrac{1,825}{36,5} = 0,05(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Vì :
$n_{Al} : 2 > n_{HCl} : 6$ nên Al dư
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,025(mol)$
$V_{H_2} = 0,025.24,79 = 0,61975(lít)$
b) $n_{Al\ pư} = \dfrac{1}{3} n_{HCl} = \dfrac{0,05}{3}(mol)$
Ta thấy : $m_{Al} - m_{H_2} = \dfrac{0,05}{3}.27 - 0,025.2 = 0,4 > 0$
Do đó, dung dịch tăng so với khối lượng dung dịch HCl ban đầu 0,4 gam

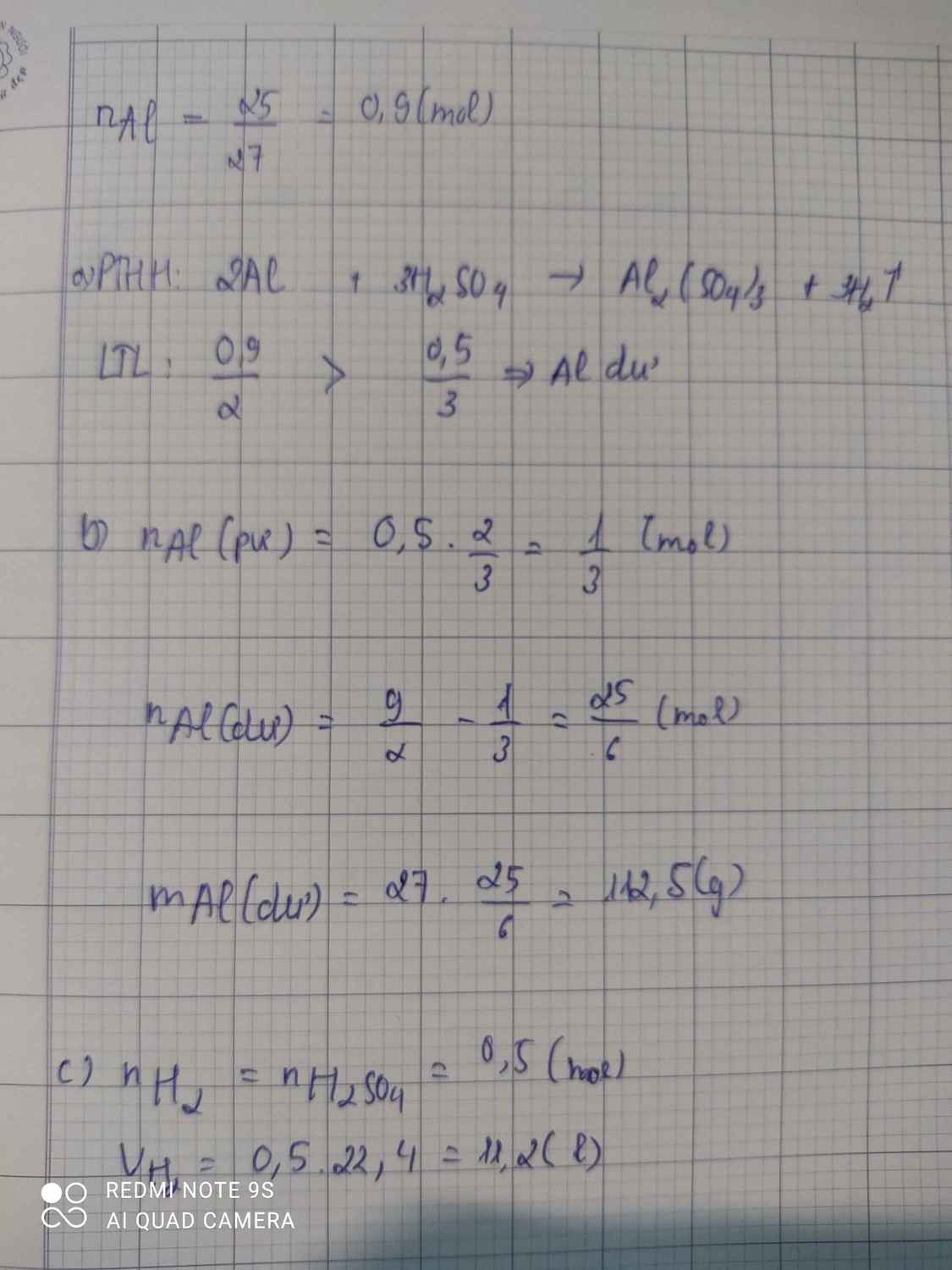


PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\) \(\Rightarrow\) Zn p/ứ hết, HCl còn dư
\(\Rightarrow n_{ZnCl_2}=n_{H_2}=0,1\left(mol\right)=n_{HCl\left(dư\right)}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,1\cdot136=13,6\left(g\right)\\m_{HCl\left(dư\right)}=0,1\cdot36,5=3,65\left(g\right)\\V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)