Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Rắn không tan là Cu
=> mCu = 1,86 (g)
Gọi số mol Fe, Al là a, b (mol)
=> 56a + 27b = 6 - 1,86 = 4,14 (1)
\(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
a--------------------->a
2Al + 6HCl --> 2AlCl3 + 3H2
b--------------------->1,5b
=> a + 1,5b = 0,135 (2)
(1)(2) => a = 0,045 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{1,86}{6}.100\%=31\%\\\%m_{Fe}=\dfrac{0,045.56}{6}.100\%=42\%\\\%m_{Al}=\dfrac{0,06.27}{6}.100\%=27\%\end{matrix}\right.\)

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Theo bài ra, ta có: \(\dfrac{1}{2}\Sigma m_{Cu}=3,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\%m_{Cu}=\dfrac{6,4}{17,2}\cdot100\%\approx37,21\%\) \(\Rightarrow\%m_{Al}=62,79\%\)
Theo PTHH: \(n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}\cdot\dfrac{\dfrac{17,2-6,4}{2}}{27}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\)

\(m_{không.tan}=m_{Cu}=2\left(g\right)\\ \Rightarrow m_{Al,Fe}=10,3-2=8,3\left(g\right)\\ Đặt:a=n_{Al}\left(mol\right);b=n_{Fe}\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=8,3\\1,5.22,4a+22,4b=5,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Rightarrow\%m_{Cu}=\dfrac{2}{10,3}.100\approx19,417\%\\ \%m_{Fe}=\dfrac{56.0,1}{10,3}.100\approx54,369\%\\ \Rightarrow\%m_{Al}\approx26,214\%\)

Không viết phương trình nhá !!
a) Gọi a và b lần lượt là số mol của Mg và Al
\(\Rightarrow24a+27b=1,035\) (1)
Ta có: \(n_{H_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\)
Bảo toàn electron: \(2a+3b=2\cdot0,0525\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015\cdot24}{1,035}\cdot100\%\approx34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) Ta có: \(\left\{{}\begin{matrix}\Sigma n_{H_2SO_4}=\dfrac{100\cdot9,8\%}{98}=0,1\left(mol\right)\\n_{H_2SO_4\left(p/ứ\right)}=n_{H_2}=0,0525\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,0475\left(mol\right)\) \(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,0475\cdot98=4,655\left(g\right)\)
c) Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,0125\left(mol\right)\\n_{MgO}=n_{Mg}=0,015\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{oxit}=0,0125\cdot102+0,015\cdot40=1,875\left(g\right)\)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(m_A=1,035\left(g\right)\rightarrow24a+27b=1,035\) (1)
\(Mg+2H_2SO_4đ\rightarrow MgSO_4+SO_2+2H_2O\)
a ------------ 2a ----------------------- a (mol)
\(2Al+6H_2SO_4đ\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
b ------------ 3b -------------------------- 1,5b (mol)
\(n_{SO_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\rightarrow a+1,5b=0,0525\) (2)
Giải hệ (1)(2) \(\rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Mg}=0,015.24=0,36\left(g\right)\\m_{Al}=0,025.27=0,675\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) \(\Sigma_{n_{H_2SO_4}}=2a+3b=0,105\left(mol\right)\)
\(\rightarrow m_{H_2SO_4}=0,105.98=10,29\left(g\right)\)
c. \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,015\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=0,0125\left(mol\right)\end{matrix}\right.\)
\(\rightarrow m_{oxit}=0,015.40+0,0125.102=1,875\left(g\right)\)

a)
Gọi : \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)⇒ 27a + 56b = 1,66(1)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe +2 HCl \to FeCl_2 + H_2\)
Theo PTHH :
\(n_{H_2} = 1,5a + b = \dfrac{1,12}{22,4} = 0,05(2)\)
Từ (1)(2) suy ra a = 0,02 ; b = 0,02
Vậy :
\(\%m_{Al} = \dfrac{0,02.27}{1,66}.100\% = 32,53\%\\ \%m_{Fe} = 100\% - 32,53\% = 67,47\%\)
a)
\(n_{HCl} = 2n_{H_2} = 0,05.2 = 0,1(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,1.36,5}{100}.100\% = 3,65\%\)

\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{rắn}=m_{Cu}=m_{hh}-m_{Al}=12-0,2.27=6,4\left(g\right)\)

\(n_{H_2} = \dfrac{4,35-3,95}{2} = 0,2(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Al:y\left(mol\right)\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}24x+27y=4,35\\x+1,5y=0,2\end{matrix}\right.\)→\(\left\{{}\begin{matrix}x=0,125\\y=0,05\end{matrix}\right.\)
Vậy :
\(\%m_{Mg} = \dfrac{0,125.24}{4,35}.100\% = 68,97\%\\ \%m_{Al} = 100\% - 68,97\% = 31,03\%\)

Đáp án B
Fe là kim loại yếu hơn Al =>Al phản ứng trước, Fe phản ứng sau => 2,4 gam kim loại chính là Fe dư
Gọi số mol các chất là Al: a mol; Fe (pứ): b mol
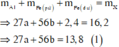
KMnO4 là chất oxi hoá mạnh, trong môi trường axit sẽ oxi hoá Fe + 2 lên Fe + 3 , Cl - 1 lên Cl 2 0 và bản thân Mn + 7 bị khử xuống Mn + 2
Như vậy, khi xét cả quá trình thì chỉ có Al, Fe và KMnO4 thay đổi số oxi hoá:
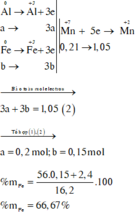


mCu = 1,92 (g)
Gọi số mol Fe, Al là a, b
=> 56a + 27b = 10,22 - 1,92 = 8,3 (g)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____a------------------------->a
2Al + 6HCl --> 2AlCl3 + 3H2
b-------------------------->1,5b
=> a + 1,5b = \(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> a = 0,1; b = 0,1
=> \(\left\{{}\begin{matrix}\%Cu=\dfrac{1,92}{10,22}.100\%=18,79\%\\\%Fe=\dfrac{0,1.56}{10,22}.100\%=54,79\%\\\%Al=\dfrac{0,1.27}{10,22}.100\%=26,42\%\end{matrix}\right.\)