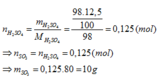Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1)
$n_{Na_2O} = \dfrac{6,2}{62} = 0,1(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 0,2(mol)$
$m_{dd} = 6,2 + 193,8 = 200(gam) \Rightarrow C\%_{NaOH} = \dfrac{0,2.40}{200}.100\% = 4\%$
2)
$n_{K_2O} = \dfrac{23,5}{94} = 0,25(mol)$
$K_2O + H_2O \to 2KOH$
$n_{KOH} = 2n_{K_2O} = 0,5(mol) \Rightarrow C_{M_{KOH}} = \dfrac{0,5}{0,5} = 1M$
3) $n_{Na_2O} = \dfrac{12,4}{62} = 0,2(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 0,4(mol)$
$C_{M_{NaOH}} = \dfrac{0,4}{0,5} =0,8M$
4)
$Na_2SO_3 + 2HCl \to 2NaCl +S O_2 + H_2O$
Theo PTHH :
$n_{SO_2} = n_{Na_2SO_3} = \dfrac{12,6}{126} = 0,1(mol)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
5) $n_{CaO} = \dfrac{5,6}{56} = 0,1(mol)$
$CaO + 2HCl \to CaCl_2 + H_2O$
Theo PTHH :
$n_{HCl} = 2n_{CaO} = 0,2(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,2.36,5}{14,6\%} = 50(gam)$

Ta có: \(n_{Fe_2O_3}=\dfrac{9,6}{160}=0,06\left(mol\right)\)
a. PTHH: Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O (1)
Theo PT(1): \(n_{H_2SO_4}=3.n_{Fe_2O_3}=3.0,06=0,18\left(mol\right)\)
=> \(m_{H_2SO_4}=0,18.98=17,64\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{17,64}{m_{dd_{H_2SO_4}}}.100\%=9,8\%\)
=> \(m_{dd_{H_2SO_4}}=180\left(g\right)\)
b. Ta có: \(m_{dd_{Fe_2\left(SO_4\right)_3}}=9,6+180=189,6\left(g\right)\)
Theo PT(1): \(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,06\left(mol\right)\)
=> \(m_{Fe_2\left(SO_4\right)_3}=0,06.400=24\left(g\right)\)
=> \(C_{\%_{Fe_2\left(SO_4\right)_3}}=\dfrac{24}{189,6}.100\%=12,66\%\)
c. PTHH: Fe2(SO4)3 + 3BaCl2 ---> 3BaSO4↓ + 2FeCl3 (2)
Theo PT(2): \(n_{BaSO_4}=3.n_{Fe_2\left(SO_4\right)_3}=3.0,06=0,18\left(mol\right)\)
=> \(m_{BaSO_4}=0,18.233=41,94\left(g\right)\)
Theo PT(2): \(n_{BaCl_2}=n_{BaSO_4}=0,18\left(mol\right)\)
=> \(m_{BaCl_2}=0,18.208=37,44\left(g\right)\)
Ta có: \(C_{\%_{BaCl_2}}=\dfrac{37,44}{m_{dd_{BaCl_2}}}.100\%=10,4\%\)
=> \(m_{dd_{BaCl_2}}=360\left(g\right)\)

Câu 10: Cho các oxit K2O ; Na2O ; P2O5 ; SO2 tác dụng với H2O sản phẩm thu được là
A) KOH ; Na(OH)2 ; P(OH)3 ; S(OH)2 B) KOH ; NaOH ; H3PO4 ; H2SO4
C) KOH ; NaOH ; H3PO4 ; H2SO3 D) K(OH)2 ; NaOH ; H3PO4 ; H2SO4
Câu 11: Cho các oxit Al2O3 ; BaO ; FeO tác dụng với dd HCl sản phẩm muối thu được là
A) AlCl ; BaCl ; FeCl B) AlCl ; BaCl ; FeCl
C) AlCl3 ; BaCl2 ; FeCl3 D) AlCl3 ; BaCl2 ; FeCl2
Câu 12: Cho các oxit P2O5 ; SO2 ; CO2 tác dụng với dd NaOH sản phẩm muối thu được là
A) NaP2O5 ; NaSO2 ; NaCO2 B) NaPO4 ; NaSO4 ; NaCO3
C) Na3PO4 ; Na2SO3 ; Na2CO3 D) Na3PO4 ; Na2SO4 ; Na2CO3
Câu 13: Biết 4,48 lít khí CO2 vào 160 ml dung dịch NaOH a M vừa đủ tạo thành dung dịch Na2CO3. Giá trị của a là:
A) 1,25. B)2,5. C) 3. D) 2,5.10-3

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2SO_4} = n_{H_2} = n_{Fe} = \dfrac{16,8}{56} = 0,3(mol)$
$V = 0,3.22,4 = 6,72(lít)$
$C_{M_{H_2SO_4}} = \dfrac{0,3}{0,25} = 1,2M$
b)
$n_{CuO} = \dfrac{16}{80} = 0,2(mol)$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
$n_{CuO} < n_{H_2}$ nên $H_2$ dư
$n_{Cu} = n_{CuO} = 0,2(mol)$
$m_{Cu} = 0,2.64 = 12,8(gam)$
\(n_{Fe}=\dfrac{m}{M}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ PT:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,3 0,3 0,3 (mol)
a) V= n. 22,4 = 0,3 . 22,4 = 6,72(l)
\(C\%=\dfrac{m_{H_2SO_4}}{m_{dd}}.100\%=\dfrac{0,3.98}{200}.100\%=11,76\%\)
b) PT: \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
0,3 0,3
=> mCu=n.M=0,3.64=19,2(g)