Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
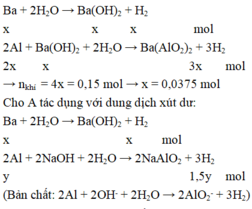

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B

Bài 1:
n H2=5.6/22.4=0.25(mol)
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2
0.25 0.25
m Zn=0.25*65=16.25(g)
m hh=16.25+6.25=22.5(g)
% Zn=16.25/22.5*100%=72.22%
% Ag=100%-72.22%=27.78%
Bài 2:
-
nH2 = 6,72/22,4 = 0,3 mol
gọi x,y lần lượt là số mol của Mg và Zn tham gia phản ứng.
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
x 2x x
Zn + 2HCl ZnCl2 + H2
ZnCl2 + H2
y 2y y
Ta có phương trình
x + y = 0,3
24x + 56y = 15,3
=> x = 0,102 ; y = 0.198
m Mg = 0,102.24 = 2,448 g
m Zn = 0,198.65 = 12.87 g
n HCl = 2.0,102+2.0,198 = 0,6 mol
V HCl = 0,6/1 = 0,6 lít.Bài 3:
TN1
n H2=3.36/22.4=0.15(mol)
Ba + 2H2O Ba(OH)2 + H2
Ba(OH)2 + H2
0.15 0.15
TN2
n H2 = 6.72/22.4=0.3(mol)
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
2NaAlO2 + 3H2
0.2 0.3
TN3
n H2=8.96/22.4=0.4(mol)
Ba + 2HCl BaCl2 + H2
BaCl2 + H2
0.15 0.15
2Al + 6HCl 2AlCl3 + 3H2
2AlCl3 + 3H2
0.2 0.2
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
0.05 0.05
m Ba=0.15*137=20.55(g)
m Al=0.2*27=5.4(g)
m Mg=0.05*24=1.2(g)
m=20.55+5.4+1.2=27.15
%Ba=20.55/27.15*100%=75.69%
%Al=5.4/27.15*100%=19.89%
%Mg=100%-75.69%-19.89%=4.42%

TN1:Cho A t/d với H2O
Ba+ H2O -------> Ba(OH)2+ H2 (1)
a........a......................a.............a
Ba(OH)2+ 2Al + 2H2O-------> Ba(AlO2)2+ 3H2(2)
a................2a........2a.......................a..............3a
TN2:Cho A t/d với xút dư (NaOH) => Al hết
Ba+ 2H2O -----> Ba(OH)2+ H2(3)
a........2a...................a.............a
NaOH+ Al+ H2O ------> NaAlO2+ 3/2H2(4)
b...........b.......b.....................b............1.5b
TN3:Cho A t/d với HCl vừa đủ
Ba+ 2HCl -------> BaCl2+ H2(5)
a........2a...................a.........a
2Al+ 6HCl --------> 2AlCl3+ 3H2(6)
b..........3b.....................b.........1.5b
Mg+ 2HCl ---------> MgCl2+ H2(7)
c..........2c.......................c..........c
(Khi Al t/d với dd kiềm hoặc kiềm thổ thì nH2=3/2nAl
Nếu TN1 và TN2 Al p/ư vừa đủ thì VH2 ở 2 pt phải bằng nhau
Mà VH2(TN1)<VH2(TN2)=> Al ở TN1 dư=> tính theo Ba(OH)2
nH2(TN1)=0.15 mol
nH2(TN2)=0.3 mol
nH2(TN3)=0.55 mol
Đặt a, b, c là số mol Ba, Al, Mg
Khi đó theo pt(1)& (2) =>nH2=a+3a=0.15mol=>a=0.0375 (I)
Theo pt(3), (4) nH2=a+1.5b=0.3 (II)
Theo pt(5), (6), (7) nH2=a+1.5b+c=0.55 (III)
Giải hệ pt (I), (II), (III) =>a=0.0375 mol, b=0.175 mol, c=0.25 mol
=> m= 0.0375*137+0.175*27+0.25*24=15.8625 g
Do đó
%mBa=(0.0375*137*100)/15.8625=32.39%
%mAl=(0.175*27*100)/15.8625=29.79%
%mMg=37.82%

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

Khi cho A vào H2O và khi cho A vào NaOH thể tích khí thoát ra khác ở TN1 bé hơn chứng tỏ trong TN1 Al dư, vậy nH2 = 0,04 mol = 4nBa => nBa = 0,01 mol
Ba + H2O ------> Ba(OH)2 + H2
Al + OH- + H2O -----> AlO2- + 3/2 H2
nOH- = 2nBa
nH2 = nBa + 3/2.2nBa = 4nBa
nH2 ở TN2 = 0,31 mol = nBa + 3/2 nAl ( Vì OH- dư)
=> nAl = 0,2 mol
nH2 ở TN3 = 0,41 mol = nBa + 3/2nAl + nMg
=> nMg = 0,1 mol
Al + 3HCl -----> AlCl3 + 3/2H2
Mg + HCl -------> MgCl2 + H2
1. m = 21,5 gam
%Ba = 0,1.137/ 21,5.100 = 63,72%
%Al = 0,2.27/ 21,5.100 = 25,12%
%Mg = 100 -25,12 - 63,62 = 11,16%

Câu 48:
\(n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=11(1)\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow 1,5x+y=\dfrac{8,96}{22,4}=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow n_{AlCl_3}=0,2(mol);n_{FeCl_2}=0,1(mol)\\ \Rightarrow m_{muối}=0,2.133,5+0,1.127=39,4(g)(B)\)
Câu 49:
\(n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=4,15(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow 1,5x+y=\dfrac{2,8}{22,4}=0,125(2)\\ (1)(2)\Rightarrow x=y=0,05(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,05.56}{4,15}.100\%=67,5\%\\ \Rightarrow \%_{Al}=100\%-67,5\%=32,5\%\\ \Rightarrow B\)
Câu 50:
\(Fe+H_2SO_4\to FeSO_4+H_2\\ Mg+H_2SO_4\to MgSO_4+H_2\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ MgSO_4+2NaOH\to Mg(OH)_2\downarrow+Na_2SO_4\\ 4Fe(OH)_2+O_2\xrightarrow{t^o}2Fe_2O_3+4H_2O\\ Mg(OH)_2\xrightarrow{t^o}MgO+H_2O\\ \Rightarrow n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{11,2}{56}=0,1(mol)\\ n_{MgO}=n_{Mg}=\dfrac{2,4}{24}=0,1(mol)\\ \Rightarrow \Sigma m_{\text{chất rắn}}=0,1.160+0,1.40=20(g)\)
Chọn B


TN1: A tác dụng với nước
Ba +2 H2O --> Ba(OH)2 + H2;
x ------------------x------------x ;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
2x--------x---------------------------------------3x;
TN2 : A tác dụng với dd xút
Ba +2 H2O --> Ba(OH)2 + H2;
x----------------------------------x;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
y-------------------------------------------------3/2y;
TN3: A tác dụng với HCl
Ba + 2HCl --> BaCl2 + H2;
x------------------------------x;
2Al + 6HCl --> 2AlCl3 + 3H2;
y------------------------------3/2y;
Mg + 2HCl --> MgCl2 + H2;
z------------------------------z;
Gọi x,y,z lần lượt là số mol của Ba, Al, Mg.
TN1: nH2= 3,36/22,4= 0,15 (mol)
=>x + 3x= 4x=0,15 => x= 0,0375 (mol)
TN2: nH2= 0,3 (mol)
=> x + 3/2 y = 0,3 => y = 0,175 (mol)
TN3: nH2= 0,4 (mol)
=> x +3/2y + z = 0,4 => Z= 0,1 (mol)
m= 0,0375*137+ 0,175*27+ 0,1*24=26,2625(g).