Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
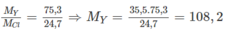
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron ; Công thức cấu tạo
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

a, X: HnA
Mà: %A = 97,27%
\(\Rightarrow\dfrac{M_A}{n+M_A}.100\%=97,27\%\Rightarrow M_A\approx35,5n\)
Với n = 1 thì MA = 35,5 (g/mol) là thỏa mãn.
→ A là Cl.
b, B thuộc nhóm IIA.
\(B+2HCl\rightarrow BCl_2+H_2\)
Ta có: \(n_{HCl}=\dfrac{200.14,6\%}{36,5}=0,8\left(mol\right)\)
Theo PT: \(n_{BCl_2}=n_{H_2}=n_B=\dfrac{1}{2}n_{HCl}=0,4\left(mol\right)\Rightarrow M_B=\dfrac{16}{0,4}=40\left(g/mol\right)\)
→ B là Ca.
Ta có: m dd sau pư = 16 + 200 - 0,4.2 = 215,2 (g)
\(\Rightarrow C\%_{CaCl_2}=\dfrac{0,4.111}{215,2}.100\%\approx20,63\%\)

Đáp án A
Đặt số proton của X, Y là ZX, ZY
Ta có 2ZX + ZY = 23 (1)
- Nếu X trước Y thì ZY = ZX + 1 (2)
Từ (1) và (2) → 2ZX + ZX + 1 = 23→ ZX = 22/3 = 7,3 (vô lí)
- Nếu Y trước X thì ZX = ZY + 1 (3)
Từ (1) và (3) → 2( ZY + 1) + ZY = 23 → 3ZY = 21
ZY = 7 → Y là nito (N)
ZX = 8 → X là oxi (O)
Công thức X2Y là NO2

D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H

Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron

A và B cùng thuộc một nhóm trong bảng tuần hoàn và A có 6 electron ở lớp ngoài cùng, vậy A là Oxy (O) và B là Lưu huỳnh (S). Hợp chất của A với Hydrogen có phần trăm khối lượng Hydrogen bằng 5,88% nên hợp chất đó là nước (H2O).
B tạo với X (nhóm VIIA) một hợp chất XzB trong đó chiếm 81,61% khối lượng. Vì B là Lưu huỳnh (S) và X thuộc nhóm VIIA nên X có thể là Flo (F), Clo (Cl), Brom (Br), Iot (I) hoặc Astatin (At). Tuy nhiên, chỉ có Clo (Cl) tạo ra hợp chất với Lưu huỳnh (S) có phần trăm khối lượng là 81,61% (hợp chất đó là SCl2).
Phân tử XY có tổng diện tích hạt nhân là 26 và X và Y cùng một chu kì ở hai nhóm liên tiếp. Vậy X có thể là Nhôm (Al) và Y là Silic (Si) vì tổng số hạt nhân của chúng là 26 và chúng cùng thuộc chu kì 3 trong bảng tuần hoàn. Vậy công thức phân tử là AlSi.