Cho 2,3 gam Na tác dụng với nước tạo thành 500ml dung dịch bazơ. a. Viết PTHH của phản ứng xảy ra. Xác định nồng độ mol của dd thu được. b. Hoà tan 2,4 gam một oxit kim loại hoá trị II cần dùng 30 gam dung dịch HCl 7,3 %. Tìm công thức của oxit?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1) Gọi công thức của oxit là AO. Số mol HCl là 0,4.1=0,4 (mol).
AO (0,2 mol) + 2HCl (0,4 mol) \(\rightarrow\) ACl2 + H2\(\uparrow\).
Phân tử khối của oxit là 8,0/0,2=40 (g/mol).
Vậy A là magie (Mg) và công thức hóa học của oxit là MgO.
2) Số mol MgCO3 và H2SO4 lần lượt là 8,4/84=0,1 (mol) và 0,5.1=0,5 (mol).
Các chất tan trong dung dịch sau phản ứng gồm MgSO4 (0,1 mol) và H2SO4 dư (0,4 mol) có nồng độ mol lần lượt là 0,1/0,5=0,2 (M) và 0,4/0,5=0,8 (M).
\(1,n_{HCl}=0,4.1=0,4\left(mol\right)\\ PTHH:AO+2HCl\rightarrow ACl_2+H_2O\\ Mol:0,2\leftarrow0,4\\ M_{AO}=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A+16=40\\ \Leftrightarrow A=24\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A.là.Mg\\ CTHH:MgO\)
\(2,n_{H_2SO_4}=1.0,5=0,5\left(mol\right)\\ PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+CO_2\uparrow+H_2O\\ Mol:0,5\leftarrow0,5\rightarrow0,5\\ C_{M\left(MgSO_4\right)}=\dfrac{0,5}{0,5}=1M\)

Ta có: \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
a. PTHH: 2Na + 2H2O ---> 2NaOH + H2↑
b. Ta có: \(n_{H_2O}=\dfrac{97,8}{18}=5,43\left(mol\right)\)
Ta thấy: \(\dfrac{0,1}{2}< \dfrac{5,43}{2}\)
=> H2O dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}.n_{Na}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
=> \(V_{H_2}=0,05.22,4=1,12\left(lít\right)\)
c. Ta có: \(m_{dd_{NaOH}}=2,3+97,8=100,1\left(g\right)\)
Theo PT: \(n_{NaOH}=n_{Na}=0,1\left(mol\right)\)
=> \(m_{NaOH}=0,1.40=4\left(g\right)\)
=> \(C_{\%_{NaOH}}=\dfrac{4}{100,1}.100\%=3,996\%\)

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
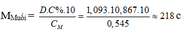
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
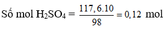
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

Cách 1: Đặt công thức hoá học của oxit là MO ⇒ công thức bazơ là M OH 2
MO + H 2 O → M OH 2
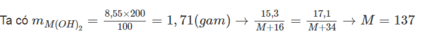
→ Công thức oxit là BaO.
Cách 2: m H 2 O ( p / u ) = m M OH 2 - m MO = 17,1 - 15,3 = 1,8(g)
MO + H 2 O → M OH 2
![]()
Công thức oxit là BaO

\(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1mol\\ 2Al\left(OH\right)_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+6H_2O\\ 0,1................0,15.............0,05............0,3\\ C_{\%H_2SO_4}=\dfrac{0,15.98}{300}\cdot100\%=4,9\%\\ C_{\%Al_2\left(SO_4\right)_3}=\dfrac{0,05.342}{7,8+300}\cdot100\%=5,56\%\)

Câu 3 :
\(n_{HCl}=\dfrac{10\cdot21.9\%}{36.5}=0.06\left(mol\right)\)
\(AO+2HCl\rightarrow ACl_2+H_2O\)
\(0.03........0.06\)
\(M=\dfrac{2.4}{0.03}=80\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=64\)
\(CuO\)
Câu 2 :
$n_{CuO} = \dfrac{1,6}{80} = 0,02(mol)$
$n_{H_2SO_4} = \dfrac{100.20\%}{98} = \dfrac{10}{49}$
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$n_{CuO} < n_{H_2SO_4}$ nên $H_2SO_4 dư
Theo PTHH :
$n_{CuSO_4} = n_{H_2SO_4\ pư} = n_{CuO} = 0,02(mol)$
$m_{dd} = 1,6 + 100 = 101,6(gam)$
Vậy :
$C\%_{CuSO_4} = \dfrac{0,02.160}{101,6}.100\% = 3,15\%$
$C\%_{H_2SO_4\ dư} = \dfrac{100.20\% - 0,02.98}{101,6}.100\% = 17,6\%$

\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)


\(a,PTHH:2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{2,3}{23}=0,1mol\\ n_{NaOH}=0,1.2=0,2mol\\ C_{M_{NaOH}}=\dfrac{0,2}{0,5}=0,4M\\ b,oxit.kl:RO\\ n_{RO}=\dfrac{2,4}{R+16}mol\\ n_{HCl}=\dfrac{30.7,3}{100.36,5}=0,06mol\\ RO+2HCl\rightarrow RCl_2+H_2O\\ \Rightarrow\dfrac{2,4}{R+16}=0,06:2\\ \Leftrightarrow R=64,Cu\)
là Cu mới đúng chứ bn , mXO= 0.03(X+16)=2.4 -> M= 64 ( Cu) , công thức oxit là CuO
hay là MXO= m/n=2.4/0.03=80 --> MX= 64 ( Cu)