Dẫn 2,24l khí Hidro qua một CuO nung nóng
a) Viết PTHH xảy ra
b)Tính khối lượng kim loại thu được sau phản ứng
c) tính khối lượng kim loại CuO sau phản ứng
d)Nếu dùng 12 gam CuO tham gia phản ứng thì sau phản ứng còn chất nào dư? Dư bao nhiêu gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 ( mol )
\(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8g\\m_{FeO}=12-8=4g\end{matrix}\right.\)

a)
FeO + H2 --to--> Fe + H2O
CuO + H2 --to--> Cu + H2O
b) \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,1<--0,1<-----0,1
=> \(m_{FeO}=12-0,1.80=4\left(g\right)\)
=> \(n_{FeO}=\dfrac{4}{72}=\dfrac{1}{18}\left(mol\right)\)
FeO + H2 --to--> Fe + H2O
\(\dfrac{1}{18}\)-->\(\dfrac{1}{18}\)----->\(\dfrac{1}{18}\)
=> \(V_{H_2}=\left(0,1+\dfrac{1}{18}\right).22,4=\dfrac{784}{225}\left(l\right)\)
c) \(m_{Fe}=\dfrac{1}{18}.56=\dfrac{28}{9}\left(g\right)\)
d) \(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8\left(g\right)\\m_{FeO}=4\left(g\right)\end{matrix}\right.\)

a) Phản ứng
CuO + H 2 → t o Cu + H 2 O (1)
(mol) 0,3 0,3 ← 0,3
b) Ta có: n Cu = 19,2/64 = 0,3 (mol)
Từ (1) → n Cu = 0,3 (mol) → m CuO = 0,3 x 80 = 24 (gam)
Và n H 2 = 0,3 (mol) → V H 2 =0,3 x 22,4 = 6,72 (lít)

PT: CuO + H2 ---> Cu + H2O
a. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: nCu = \(n_{H_2}=0,3\left(mol\right)\)
=> mCu = 0,3 . 64 = 19,2(g)
Theo PT: \(n_{H_2O}=n_{Cu}=0,3\left(mol\right)\)
=> \(m_{H_2O}=0,3.18=5,4\left(g\right)\)
b. Theo PT: nCuO = nCu = 0,3(mol)
=> mCuO = 0,3 . 80 = 24(g)

a) CuO + H2 → Cu + H2O
Sản phẩm thu được sau phản ứng là Cu và H2O
b) nCuO = 1.6 : 80 = 0,02 mol
Theo tỉ lệ phản ứng => nCu = nCuO = 0,02 mol
<=> mCu = 0,02.64 = 1,28 gam

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
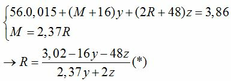
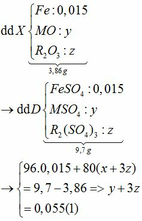
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

cop tên ng ta nè
a) CuO+H2−to→Cu+H2OCuO+H2−to→Cu+H2O
nCuO(bđ)=1680=0,2(mol)nCuO(bđ)=1680=0,2(mol)
⇒nCuO(pứ)=0,2.80%=0,16(mol)⇒nCuO(pứ)=0,2.80%=0,16(mol)
nH2O=nCuO=0,16(mol)nH2O=nCuO=0,16(mol)
=> mH2O=0,16.18=2,88(g)mH2O=0,16.18=2,88(g)
b) nH2=0,15(mol)nH2=0,15(mol)
Lập tỉ lệ : 0,21>0,151⇒0,21>0,151⇒Sau phản ứng CuO dư
Chất rắn sau phản ứng là Cu, CuO dư
mcr=0,15.64+(0,2−0,15).80=13,6(g)mcr=0,15.64+(0,2−0,15).80=13,6(g)
c) Gọi x là số mol CuO phản ứng
mcr=(0,2−x).80+64x=13,28mcr=(0,2−x).80+64x=13,28
=> x=0,17 (mol)



a) PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
b+c) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{CuO}=n_{Cu}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu}=0,1\cdot64=6,4\left(g\right)\\m_{CuO}=80\cdot0,1=8\left(g\right)\end{matrix}\right.\)
d) Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
\(\Rightarrow\) CuO còn dư, Hidro p/ứ hết
\(\Rightarrow n_{CuO\left(dư\right)}=0,05\left(mol\right)\) \(\Rightarrow m_{CuO\left(dư\right)}=80\cdot0,05=4\left(g\right)\)