Cho 22 gam hỗn hợp X gồm Al và Fe tác dụng vừa đủ với 0,2 lít dung dịch hcl có nồng độ 4 M tính thành phần phần trăm theo khối lượng của Al và Fe trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

\(n_{Al}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=19.3\left(g\right)\left(1\right)\)
\(n_{H^+}=0.2\cdot2+0.2\cdot2.25\cdot2=1.3\left(mol\right)\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(Fe+2H^+\rightarrow Fe^{2+}+H_2\)
\(n_{H^+}=3a+2b=1.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.2\)
\(\%Al=\dfrac{0.3\cdot27}{19.3}\cdot100\%=41.96\%\)
\(\%Fe=58.04\%\)
\(b.\)
\(n_{H_2}=\dfrac{1}{2}n_{H^+}=0.65\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=19.3+0.4\cdot36.5+0.45\cdot98-0.65\cdot2=76.7\left(g\right)\)

Chọn B
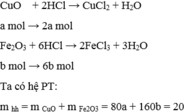
Gọi a là số mol của CuO và b là số mol của F e 2 O 3 có trong 20 gam
hh 200 ml dd HCl 3,5 M => nHCl = 0,2 . 3,5 = 0,7 mol
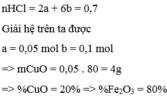

Gọi $n_{Fe} = a(mol), n_{Zn} = b(mol) , n_{Al} = c(mol) \Rightarrow 56a + 65b + 27c = 20,4(1)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
Theo PTHH : $n_{H_2} = a + b + 1,5c = \dfrac{10,08}{22,4} = 0,45(mol)(2)$
Mặt khác :
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
Theo PTHH : $n_{Cl_2} = 1,5n_{Fe} + n_{Zn} + 1,5n_{Al}$
Suy ra : \dfrac{1,5a + b + 1,5c}{a + b + c} = \dfrac{0,275}{0,2}(3)$
Từ (1)(2)(3) suy ra : a = 0,2 ; b = 0,1 ; c = 0,1
$\%m_{Fe} = \dfrac{0,2.56}{20,4}.100\% = 54,9\%$
$\%m_{Zn} = \dfrac{0,1.65}{20,4}.100\% = 31,9\%$
$\%m_{Al} = 100\% - 54,9\% - 31,9\% = 13,2\%$

Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) Gọi x,y là số mol Al, Fe
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Ta có hệ : \(\left\{{}\begin{matrix}27x+56y=0,83\\\dfrac{3}{2}x+y=0,02\end{matrix}\right.\)
=> \(x=\dfrac{29}{5700};y=\dfrac{47}{3800}\)
\(\%m_{Al}=\dfrac{\dfrac{27}{5700}.27}{0,83}.100=16,55\%\); \(\%m_{Fe}=100-16,55=83,45\%\)
c)Bảo toàn nguyên tố H: \(n_{H_2SO_4}=n_{H_2}=0,02\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,02.98}{200}.100=0,98\%\)

Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

Đáp án : D
Gọi số mol Al ; Zn ; Fe lần lượt là x ; y ; z
=> 27x + 65y + 56z = 20,4 (1)
Và 1,5x + y + z = nH2 = 0,45 (2)
Xét 0,2 mol X có lượng chất gấp t lần 20,4g X
=> t(x + y +z) = 0,2 mol (3)
Lại có : Bảo toàn e : 2nCl2 = (3x + 2y + 3z)t = 0,55 (4)
Từ (1),(2),(3),(4) => x = y = 0,1 ; z = 0,2
=> %mAl(X) = 13,24%


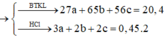
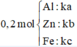
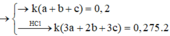
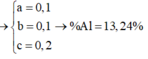

\(2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ n_{HCl}=0,2.4=0,8(mol)\\ \Rightarrow \begin{cases} 56.n_{Fe}+27.n_{Al}=22\\ 2.n_{Fe}+3.n_{Al}=0,8 \end{cases}\Rightarrow \begin{cases} n_{Fe}=0,39(mol)\\ n_{Al}=0,007(mol) \end{cases}\\ \Rightarrow \begin{cases} \%m_{Fe}=\dfrac{0,39.56}{22}.100\%=99,27\%\\ \%m_{Al}=100\%-99,27\%=0,73\% \end{cases}\)