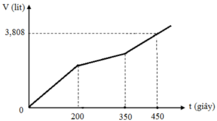
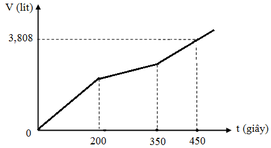
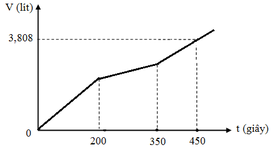
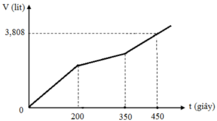
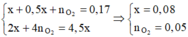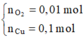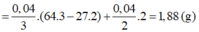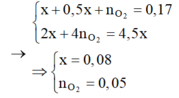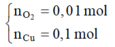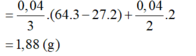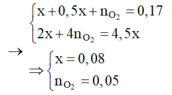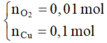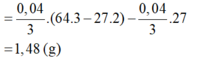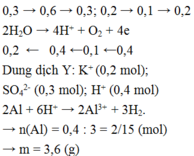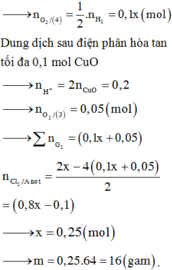Hòa tan m gam hỗn hợp CuSO4 và KCl vào nước thu được dung dịch X. Điện phân dung dịch X với cường độ dòng điện không đổi (điện cực trơ, màng ngăn xốp). Thể tích khí (V) thoát ra theo thời gian (t) được biểu diễn theo đồ thị sau:
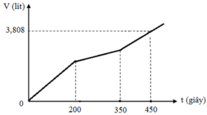
Nếu dừng điện phân ở thời điểm 250 giây rồi đem nhúng thanh nhôm (dư) vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh nhôm thay đổi như thế nào?
A. Tăng 1,75 gam
B. Tăng 1,48 gam
C. Giảm 1,25 gam
D. Giảm 0,918 gam