Hòa tan hết hỗn hợp kim loại ( M g , A l , Z n ) trong dung dịch H N O 3 loãng vừa đủ thu được dung dịch X và không có khí thoát ra. Cô cạn cẩn thận dung dịch X thu được m gam muối khan (trong đó oxi chiếm 61,364% về khối lượng). Nung m gam muối khan đến khối lượng không đổi thu được 19,2g chất rắn. Giá trị của m gần nhất với:
A. 65
B. 70
C. 75
D. 80


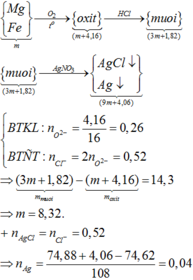

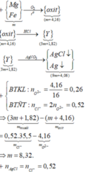
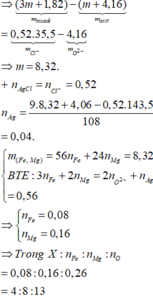
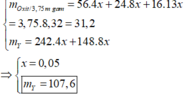
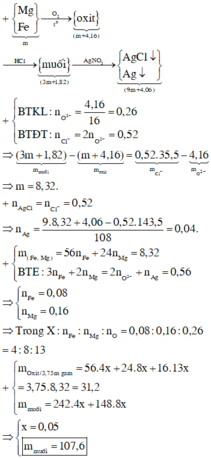

Đáp án B
(*) Phương pháp: Bảo toàn e, Bảo toàn khối lượng
- Lời giải: Vì KL + H N O 3 không có khí thoát ra
⇒ sản phẩm khử là N H 4 N O 3
n O ( X ) = 0 , 61364 m / 16 ( m o l )
n N O 3 = n e t d + n N H 4 N O 3 = 1 3 n O ( X ) = 0 , 61364 / 48 ( m o l )
⇒ n O 2 = 0 , 61364 m / 216 ( m o l )
Bảo toàn khối lượng
m X - m r a n = m N H 4 N O 3 + m N O 2 + m O 2
⇒ m = 70 , 4 g