Cho dung dịch X chứa NaCl và AlCl3. Điện phân 500 ml dung dịch X bằng dòng điện có cường độ không đổi I = 5A (có màng ngăn, hiệu suất 100%). Khi vừa hết khí Y thoát ra trên anot thì dừng điện phân, thu được 19,04 lít khí Y (đktc), trong dung dịch có 23,4 gam kết tủa keo. Nồng độ mol dung dịch sau điện phân là (coi thể tích dung dịch không đổi khi điện phân)
A. 0,6M
B. 0,4M
C. 0,75M
D. 0,8M


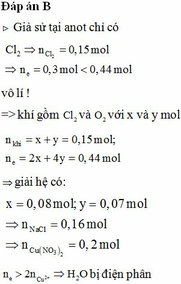










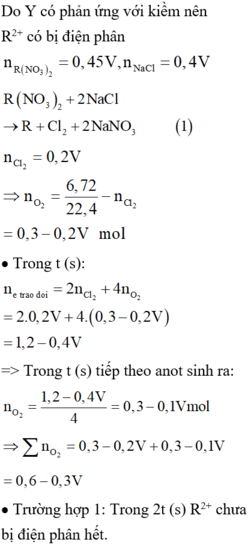


Dung dịch sau điện phân có 0,2 mol NaAl(OH)4
Nông độ dung dịch: 0 , 2 0 , 5 = 0 , 4