Nung nóng 30,52 gam hỗn hợp rắn gồm Ba(HCO3)2 và NaHCO3 đến khi khối lượng không đổi. thu được 18,84 gam rắn X và hỗn hợp Y chứa khí và hơi. Cho toàn bộ X vào lượng nước dư, thu được dung dịch Z. Hấp thụ 1/2 hỗn hợp Y vào dung dịch Z thu được dung dịch T chứa những chất tan nào?
A. NaHCO3
B. Na2CO3 và NaHCO3
C. Ba(HCO3)2 và NaHCO3
D. Na2CO3



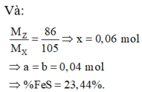
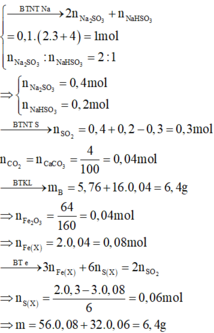





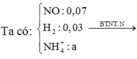
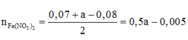
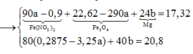
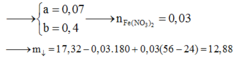

Chọn B