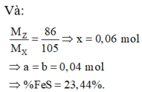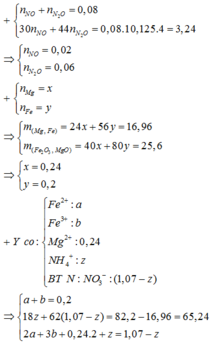Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

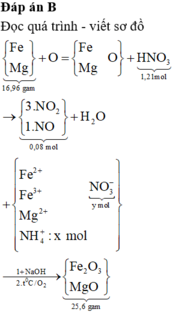
Đáp án B
Đọc quá trình - viết sơ đồ
→ quan sát:
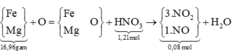
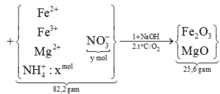
giải hệ Fe, Mg với giả thiết đầu
cuối có nFe = 0,2 mol và nMg = 0,24 mol.
gọi x, y như trên. bảo toàn N có:
x + y + (0,02 + 0,06 × 2) = 1,21 mol.
Khối lượng muối:
mmuối = 82,2 gam = 18x + 62y + 16,96.
Giải hệ được
x = 0,025 mol
và y = 1,045 mol.
→ giải hệ dung dịch Y có
nFe2+ = 0,06 mol và nFe3+ = 0,14 mol.
Mặt khác, bảo toàn electron lại có:
nHNO3 phản ứng = 10nNH4+ + 10nN2O + 4nNO + 2nO trong oxit
→ nO trong oxit = 0,14 mol
→ mX = 19,2 gam.
Theo đó, mdung dịch Y = 257,96 gam.
→ Yêu cầu C%Fe(NO3)3 trong Y = 0,14 × 242 ÷ 257,96
≈ 13,13%.

Đáp án B
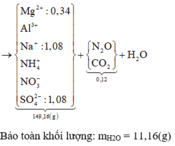
Ta có: nKHSO4 = 0,8 mol và nHNO3 = 0,15 mol
Ta có: MZ = 44 g/mol suy ra Z gồm 2 khí là CO2 và N2O
Bảo toàn khối lượng ta có: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
→ mH2O = 19,55 + 108,8 + 9,45 - 125,75 - 0,1.44 = 7,65 gam → nH2O = 0,425 mol
Bảo toàn nguyên tố H ta có: nKHSO4+ nHNO3 = 4.nNH4++ 2.nH2O
Suy ra nNH4+ = 0,025 mol
Cho dung dịch NaOH đến dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 10 gam chất rắn khan. Chất rắn khan đó là MgO suy ra mMgO = 10 gam.
Ta có: nMgO = 0,25 mol
Vậy dung dịch Y gồm Mg2+ (0,25 mol), K+ (0,8 mol), SO42- (0,8 mol), Zn2+ (a mol), NH4+ (0,025 mol) và NO3- (b mol)
Áp dụng định luật bảo toàn điện tích ta có:
0,25.2 + 0,8 + 2a + 0,025 = b + 0,8.2
Ta có: khối lượng muối trong dung dịch Y là:
mmuối = 0,25.24 + 0,8.39 + 0,8.96 + 65a + 18.0,025 + 62b = 127,75
Giải hệ trên ta có: a = 0,15 và b = 0,025
Bảo toàn nguyên tố N ta tìm được nN2O = 0,05 mol suy ra nCO2 = 0,05 mol
Ta có: nH+ = 0,8 + 0,15 = 10.nN2O + 10.nNH4+ + 2.nO suy ra nO = 0,1 mol
Ta có: nO = nZnO + nMgCO3 suy ra nZnO = 0,05 mol
Bảo toàn nguyên tố Zn suy ra nZn = 0,1 mol Suy ra %mZn = 33,25%