Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1 M và CH3COONa 0,1 M. Biết ở 25°C, K của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25°C là:
A. 1,00
B. 4,24
C. 2,88
D. 4,76
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do đây là dung dịch đệm nên ta có CT tính nhanh : pH = pKa + log(Cb/Ca) (Ca là nồng độ mol của axit ; Cb là nồng độ mol của muối)
=> pH = 4,28
=>A

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
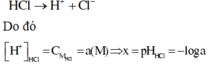
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
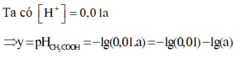
![]()
Đáp án A.

Đáp án D
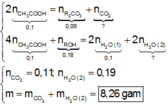
Sau tất cả các phản ứng, R trong ROH đã chuyển hết vào R 2 CO 3 .
Áp dụng bảo toàn nguyên tố đối với R, ta có :
![]()
![]()
![]()
Sơ đồ phản ứng :
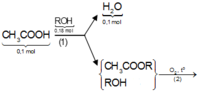
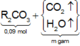
Áp dụng bảo toàn nguyên tố đối với C và H cho toàn bộ quá trình phản ứng, ta có :

HD:
CH3COOH \(\leftrightarrow\) CH3COO- + H+
Ban đầu: 0,1 M 0,1 M 0
Cân bằng: 0,1-x 0,1+x x
Hằng số cb: ka = [CH3CO-][H+]/[CH3COOH] = (0,1+x).x/(0,1-x) = 1,76.10-5. Giải pt thu được x, mà [H+] = x nên pH = -log[H+] = -log(x).
em cũng có thể dùng công thức pH= -LogKa + Log(Cb/Ca)
với Cb,Ca là nồng độ bazo và axit

Đáp án B
Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
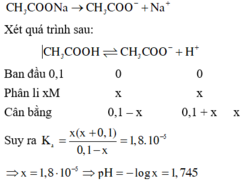

Chọn đáp án A
X C 3 H 5 O H 3 - x O O C C H 3 x : a m o l C H 3 C O O H : b m o l
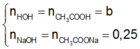
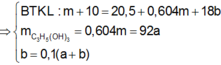
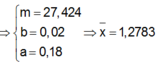
E : 8 n C H 3 C O O H + 14 + 8 x n C 3 + 2 x H 8 + 2 x O 3 + x = 4 n O 2
⇒ n O 2 = 1 , 13 m o l
⇒ V O 2 d k t c = 25 , 3162
( gần nhất với 25,3)

\(NH_3+H_2O⇌NH_4^++OH^-\)
Bđ: 0,05 0,1 0 (M)
Pư: x x+0,1 x (M)
Cb: 0,05-x x+0,1 x (M)
Có: \(\dfrac{\left[NH_4^+\right]\left[OH^-\right]}{\left[NH_3\right]}=K_c\) \(\Rightarrow\dfrac{\left(x+0,1\right).x}{0,05-x}=1,74.10^{-5}\Rightarrow x\approx8,7.10^{-6}\)
⇒ pH = 14 - (-log[OH-]) = 8,94
Vì muối CH3COONa là chất điện li mạnh nên ta có
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
Đáp án D.