Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2

Đáp án D
Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li
⇒ nH+/HCl = 100nH+/ CH3COOH
Mà dung dịch HCl và CH3COOH có cùng nồng độ
⇒ [H+/HCl] = 100[H+/ CH3COOH]
⇒ -log[H+/HCl] = -2 - log[H+/ CH3COOH]
⇒ x = -2 + y ⇒ y = x + 2
Đáp án D.

Chọn đáp án D
Đây là 2 dung dịch có môi trường bazo.NaOH có tính bazo mạnh hơn nên x >y.

Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
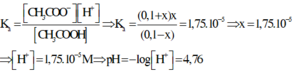
Đáp án D.

Đáp án C
Ba(HCO3)2 + NaHSO4® BaSO4 ↓+ NaHCO3 + CO2 ↑+ H2O
Vậy sau phản ứng, trong dung dịch còn lại các ion Na+ và HCO3-.

Chọn đáp án D
X có pH = 8,42 > 7 => có môi trường bazo => X là C6H5NH2
Z có pH = 2 => là axit mạnh => Z là HCl
Y có pH = 3,22 < pH của T = 3,45 => tính axit của Y mạnh hơn của T => Y là HCOOH và T là CH3COOH.
A. Sai vì C6H5NH2 không có phản ứng tráng gương.
B. Sai HCOOH không thể điều chế được từ C2H5OH
C. Sai vì HCOOH chỉ làm mất màu dung dịch nước brom chứ không tạo kết tủa với dd nước brom
D. Đúng vì CH3COOH có thể làm giấm ăn,…



Không mất tính tổng quát, ta đặt:
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
Đáp án A.