Trộn 200g dung dịch Na2Co3 13,25% vào 350g dung dịch BaCl2 20,8%
a)Chất nào còn dư
b)Tính C% dung dịch sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Na_2CO_3}=\dfrac{200.13,25%}{100\%.106}=0,25(mol)\\ n_{BaCl_2}=\dfrac{20,8\%.300}{100\%.208}=0,3(mol)\\ PTHH:Na_2CO_3+BaCl_2\to BaSO_4\downarrow +2NaCl\)
Vì \(\dfrac{n_{Na_2CO_3}}{1}<\dfrac{n_{BaCl_2}}{1}\) nên \(BaCl_2\) dư
Do đó dd sau p/ứ gồm \(BaCl_2\) dư và \(NaCl\)
\(n_{BaSO_4}=0,25(mol);n_{NaCl}=0,5(mol);n_{BaCl_2(dư)}=0,3-0,25=0,05(mol)\\ \Rightarrow m_{NaCl}=0,5.58,5=29,25(g);m_{BaCl_2(dư)}=0,05.208=10,4(g)\\ \Rightarrow C\%_{NaCl}=\dfrac{29,25}{200+300-0,25.233}.100\%=6,62\%\\ C\%_{BaCl_2(dư)}=\dfrac{10,4}{200+300-0,25.233}.100\%=2,35\%\)

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
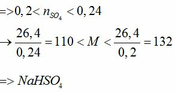
b)
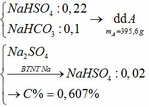
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

. Do trộn 100g với 100g mà lượng dung dịch thu được < 200g thì muối sunfat kim loại là muối axit.( do sự thất thoát khí )
pt : 2MHSO4 + 2NaHCO3 = M2SO4 + Na2SO4 + 2CO2 + 2H2O
Sự thoát khí CO2 làm giảm khối lượng ( số mol CO2 = số mol NaHCO3 0,05mol)
gọi số mol của MHSO4 là x ta có:
(M + 97) x = 13,2 => x = 13,2/ (M + 97)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 = BaSO4 + MCl + NaCl
=> Với 0,1 < x < 0,1 + 0,02 thì 13< M < 35 thoả mãn Na = 23 Vậy công thức sunfat là NaHSO4

nNa2CO3=[(5,3%.200)/100]: 106=0,1(mol)
PTHH: Na2CO3 + Ca(OH)2 -> 2 NaOH + CaCO3
Đề bảo tính gì em ơi?

nNa2CO3=[(5,3%.200)/100]: 106=0,1(mol)
PTHH: Na2CO3 + Ca(OH)2 -> 2 NaOH + CaCO3
nCaCO3=nNa2CO3=0,1(mol)
=>m(rắn)=mCaCO3=0,1.100=10(g)
nNaOH=2.0,1=0,2(mol)
=> mNaOH=0,2.40=8(g)
mddNaOH= 200+200-10=390(g)
=>C%ddNaOH=(8/390).100=2,051%
Khối lượng của natri cacbonat
C0/0Na2CO3 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{5,3.200}{100}=10,6\left(g\right)\)
Số mol của natri cacbonat
nNa2CO3= \(\dfrac{m_{Na2CO3}}{M_{Na2CO3}}=\dfrac{10,6}{106}=0,1\left(mol\right)\)
Khối lượng của canxi hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,4.200}{100}=14,8\left(g\right)\)
Số mol của natri hidroxit
nNaOH = \(\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{14,8}{40}=0,37\left(mol\right)\)
Pt : Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3\(|\)
1 1 2 1
0,1 0,37 0,2 0,1
a) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,37}{1}\)
⇒ Na2CO3 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của Na2CO3
Số mol của canxi cacbonat
nCaCO3 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của canxi cacbonat
mCaCO3 = nCaCO3 . MCaCO3
= 0,1 . 100
= 10 (g)
b) Số mol của natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2 . 40
= 8 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,37 - (0,1 .1)
= 0,36 (mol)
Khối lượng dư của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,36 . 74
= 26,64 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mNa2CO3 + mCa(OH)2
= 200 + 200
= 400 (g)
Nồng độ phần trăm của natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8.100}{400}=2\)0/0
Nồng độ phần trăm của dung dịch canxi hidroxit
C0/0Ca(OH)2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{26,64.100}{400}=6,66\)0/0
Chúc bạn học tốt

a. \(nFe=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(mHCl=\dfrac{200.9,125}{100}=18,25\left(g\right)\)
\(nHCl=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
1 2 1 1 (mol)
0,2 0,4 0,2 0,2
LTL : \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
=> Fe đủ , HCl dư
mHCl ( dư ) = 0,1 . 36,5 = 3,65(g)
b.
mFeCl2 = 0,2 . 127 = 25,4 (g)
mH2 = 0,2 . 2 = 0,4 (g)
mdd = mFe + mdd HCl + mFeCl2 - mH2
mdd = 11,2 + 200 + 25,4 - 0,4 = 236,2(g)
\(C\%_{ddHCl}=\dfrac{3,65.100}{236,2}=1,55\%\)
\(C\%_{FeCl_2}=\dfrac{25,4.100}{236,2}=10,75\%\)
\(C\%_{H_2}=\dfrac{0,4.100}{236,2}=0,17\%\)
Ta có :
nNa2CO3=200.13,25%\106=0,25(mol)
nBaCl2=350.20,8%\208=0,35(mol)
Na2CO3+BaCl2→BaCO3+2NaCl
Ta thấy : nNa2CO3=0,25<nBaCl2=0,35
nên BaCl2dư
Theo phương trình , có :
nBaCl2(pư)=nBaCO3=nNa2CO3=0,25(mol)
nNaCl=2nNa2CO3=0,25.2=0,5(mol)
⇒nBaCl2(dư)=0,35−0,25=0,1(mol)
Sau phản ứng,
mdd=ndd Na2CO3+mdd BaCl2−mBaCO3
=200+350−0,25.197=500,75(gam)
Vậy :
C%BaCl2(dư)=0,1.208\500,75.100%=4,15%
C%NaCl=0,5.58,5\500,75.100%=5,84%
%tk