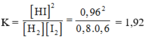13. Xét phản ứng thuận nghịch: H2 + I2 2HI, ở 410o C, hằng số của tốc độ phản ứng thuận kt = 0,0659 và hằng số tốc độ pứ nghịch kn = 0,0017. Giả sử lúc ban đầu ta trộn 1mol H2 với 1 mol I2 ở trong bình có dung tích 1 lít. Khi đạt đến cân bằng ở 410o C, nồng độ các chất sẽ là bao nhiêu?
14. Ở 600K đối với phản ứng: H2 + CO2 H2O + CO nồng độ cân bằng của H2, CO2, H2O và CO lần lượt bằng 0,4; 0,5; 0,6 và 0,7 mol/l. a) Tìm KC, Kp của phản ứng. Cho biết R = 0,08205 atm.l/ mol.K. b) Nếu lượng ban đầu của H2 và CO2 lần lượt bằng 1 mol và 2 mol được đặt vào bình 4 lít thì nồng độ cân bằng các chất bằng bao nhiêu?
làm z moi nguoi