Đốt m gam bột sắt trong không khí thu được 6,52 gam chất rắn X gồm Fe, Fe3O4, Fe2O3. Để hoà tan hỗn hợp X cần vừa hết 120ml dung dịch H2SO4 1M, tạo thành 0,224l khí ở đktc. Tính m gam bột sắt ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$n_{H_2SO_4} = 0,18(mol) \Rightarrow n_{H^+} = 0,18.2 = 0,36(mol)$
$n_{H_2} = \dfrac{0,336}{22,4} = 0,015(mol)$
$2H^+ + O^{2-} \to H_2O$
$2H^+ + 2e \to H_2$
Ta có :
$n_{H^+} = 2n_O + 2n_{H_2} \Rightarrow n_O = \dfrac{0,36 - 0,015.2}{2} = 0,165(mol)$
$\Rightarrow m = m_X - m_O = 11,04 - 0,165.16 = 8,4(gam)$

Hỗn hợp gồm Fe,Fe2O3,Fe3O4,FeO (coi hỗn hợp gồm Fe và O )
nFe=0,01 mol
=>nH2SO4 p/ư với Fe =0,01mol
=>nH2SO4 p/ư với oxit=0,11mol
=>n[O]=0,11mol
=> mFe ban đầu =7,36-0,01x16=5,6 g
Khi cho hh Fe,FeO,Fe3O4 vao dd H2SO4 thì thoát ra 0.01 mol H2 nên nFe trong hh =0.01mol
bạn để ý thấy trong oxits sắt thì có bao nhiêu ngtu O thì sẽ có bấy nhiêu gốc SO4 2- kết hợp vs Fe khi cho õit đó vào dd H2SO4 loãng
như vẬY nH2SO4 dùng để hoà tan oxits sắt là 0.12-nH2SO4(hoà tan Fe)=0.12-0.01=0.11
như vậy nO trong ôxuts sắt =nH2SO4 hoà tan ôxits sắt=0.11
nên m=7.36-0,11.16=5.6g

Hỗn hợp gồm Fe,Fe2O3,Fe3O4,FeO (coi hỗn hợp gồm Fe và O )
nFe=0,01 mol
=>n H2S04 p/ư với Fe =0,01mol
=>n H2S04 p/ư với oxit=0,11mol
=>n[O]=0,11mol
=> mFe ban đầu =7,36-0,01x16=5,6 g

Quy đổi hỗn hợp thành : Fe ( x mol ) , O ( y mol )
\(m=56x+16y=12\left(g\right)\left(1\right)\)
Bảo toàn e :
\(3x=0.1\cdot3+2y\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\cdot\left(g\right)\)
\(m_{Fe\left(NO_3\right)_3}=0.18\cdot242=43.56\left(g\right)\)

Fe + O2 ----> 2FeO (1)
4Fe + 3O2 -----> 2Fe2O3 (2)
3Fe + 2O2 -----> Fe3O4 (3)
hh X gồm Fe dư, FeO, Fe2O3, Fe3O4.
120 ml = 0,12 (lít)
nH2SO4 = VH2SO4. CM = 0,12.1 = 0,12 (mol) ; nH2(đktc) = 0,224 : 22,4 = 0,01 (mol)
PTHH: Fe + H2SO4 ---> FeSO4 + H2 (4)
FeO + H2SO4 ---> FeSO4 + H2O (5)
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O (6)
Fe3O4 + 4H2SO4 ---> FeSO4 + Fe2(SO4)3 + H2O (7)
Từ PTHH (4) ta thấy: nH2SO4 (4) = nH2 = 0,01 (mol)
=> nH2SO4(5+6+7) = 0,12 - 0,01 = 0,11 (mol)
Theo PTHH (5,6,7) ta có: nO (trong oxit) = nH2SO4 = 0,11 (mol)
Xét hh X: có mX = mFe + mO (trong oxit)
=> 7,36 = mFe + 0,11.56
=> mFe = 1,2 (g)

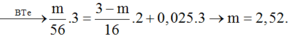
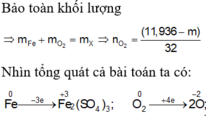
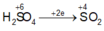
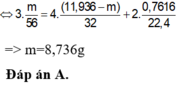
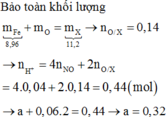

Các PTHH:
X + H2SO4:
Fe + H2SO4 ---> FeSO4 + H2
FeO + H2SO4 ---> FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 +3 H2O
Fe3O4 + 4H2SO4 ---> FeSO4 + Fe2(SO4)3 +4 H2O
Ta có: nH2SO4 =1.0,12= 0,12 ( mol)
nH2 =\(\frac{0,224}{22,4}\)= 0,01 (mol)
Hỗn hợp gồm Fe,Fe2O3,Fe3O4,FeO (coi hỗn hợp gồm Fe và O )
nFe=0,01 mol
=>n H2S04 p/ư với Fe =0,01mol
=>n H2S04 p/ư với oxit=0,11mol
=>n[O]=0,11mol
=> mFe ban đầu =6,52-0,01x16=4,92 g